早教吧作业答案频道 -->化学-->
氯酸钠(NaClO3)是无机盐工业的重要产品之一.(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的(填试剂化学式),过滤后即可得到.(2)
题目详情
氯酸钠(NaClO3)是无机盐工业的重要产品之一.
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的___(填试剂化学式),过滤后即可得到.
(2)实验室制取氯酸钠可通过如下反应:
3C12+6NaOH
5NaC1+NaC1O3+3H2O
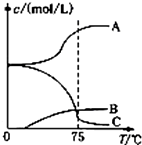
先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如图表1所示,图中C表示的离子是___.(填离子符号)
图表(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠.则阳极反应式为:___.
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液.
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L (NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min.
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,记录消耗消耗K2Cr2O7标准溶液的体积.
步骤4:为精确测定样品中C1O3-的质量分数,重复上述步骤2、3操作2-3次.
步骤5:数据处理与计算.
①步骤2中反应的离子方程式为___;
静置10min的目的是___.
②步骤3中K2Cr2O7标准溶液应盛放在___(填仪器名称)中.
③用0.0200mol/L K2Cr2O7标准溶液滴定的目的是___.
④在上述操作无误的情况下,所测定的结果偏高,其可能的原因是___.

(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的___(填试剂化学式),过滤后即可得到.
(2)实验室制取氯酸钠可通过如下反应:
3C12+6NaOH
| ||
先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如图表1所示,图中C表示的离子是___.(填离子符号)
图表(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠.则阳极反应式为:___.
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液.
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L (NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min.
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,记录消耗消耗K2Cr2O7标准溶液的体积.
步骤4:为精确测定样品中C1O3-的质量分数,重复上述步骤2、3操作2-3次.
步骤5:数据处理与计算.
①步骤2中反应的离子方程式为___;
静置10min的目的是___.
②步骤3中K2Cr2O7标准溶液应盛放在___(填仪器名称)中.
③用0.0200mol/L K2Cr2O7标准溶液滴定的目的是___.
④在上述操作无误的情况下,所测定的结果偏高,其可能的原因是___.
▼优质解答
答案和解析
(1)热的石灰乳通入氯气,反应的方程式为:2Cl2+2Ca(OH)2
CaCl2+Ca(ClO)2+2H2O,除去CaCl2后主要成分为Ca(ClO)2,要加入钠盐得到NaClO3,应加入Na2CO3,发生复分解反应生成碳酸钙沉淀,
故答案为:Na2CO3;
(2)氯气与氢氧化钠反应温度低时生成NaClO,温度高时生成NaC1O3,图中C的浓度随着温度的升高而减小,所以C代表ClO-;
故答案为:ClO-;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,阳极发生氧化反应,电极方程式为Cl--6e-+6OH-=C1O3-+3H2O,故答案为:Cl--6e-+6OH-=C1O3-+3H2O;
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,静置10min可以使亚铁离子和ClO3-充分反应,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;使溶液中C1O3-与Fe2+反应充分完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③K2Cr2O7具有氧化性,与亚铁离子反应,可确定步骤②消耗的(NH4)2Fe(SO4)2的量,故答案为:计算步骤②消耗的(NH4)2Fe(SO4)2的量;
④如果溶液中的Fe2+被空气中的氧气,则溶液中Fe2+的浓度会减小,在滴定时消耗的(NH4)2Fe(SO4)2溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+被空气中的氧气氧化.
| ||
故答案为:Na2CO3;
(2)氯气与氢氧化钠反应温度低时生成NaClO,温度高时生成NaC1O3,图中C的浓度随着温度的升高而减小,所以C代表ClO-;
故答案为:ClO-;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,阳极发生氧化反应,电极方程式为Cl--6e-+6OH-=C1O3-+3H2O,故答案为:Cl--6e-+6OH-=C1O3-+3H2O;
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,静置10min可以使亚铁离子和ClO3-充分反应,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;使溶液中C1O3-与Fe2+反应充分完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③K2Cr2O7具有氧化性,与亚铁离子反应,可确定步骤②消耗的(NH4)2Fe(SO4)2的量,故答案为:计算步骤②消耗的(NH4)2Fe(SO4)2的量;
④如果溶液中的Fe2+被空气中的氧气,则溶液中Fe2+的浓度会减小,在滴定时消耗的(NH4)2Fe(SO4)2溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+被空气中的氧气氧化.
看了 氯酸钠(NaClO3)是无机...的网友还看了以下:
在钠、氯化钠、氯化氢三种物质中,由分子构成的是(用化学式表示,下同),由原子直接构成的是,由离子构 2020-05-02 …
某种碳酸钠结晶水合物化学式为NaCO3xH2O.称取4.640该结晶水合物,加热使其全部失去结晶水 2020-05-13 …
下面是钠元素和氯元素在元素周期表中的信息和4种粒子的结构示意图.请回答下列问题:(1)氯元素的相对 2020-05-14 …
20℃时,碳酸氢钠的溶解度为9.7g,其含义是在20℃时,;工业上用氨碱法制纯碱时,向饱和氨盐水中 2020-05-17 …
化学计算一题加热3.22g硫酸钠结晶水合物,得1.42g硫酸钠粉末,则该水化合物的化学式是--- 2020-06-11 …
我已经知道水中硅离子的浓度了,比如是1.04×104mg/L.请问如何计算硅酸钠在水中的百分含量. 2020-07-06 …
怎样去除乙醇中的硫酸钠硫酸钠不溶于乙醇,用蒸馏分离的话在釜底形成硫酸钠结晶,不易清理。有没有通过过 2020-07-06 …
醋酸钠取暖包原理中轻捻金属片为什么可以引发少量醋酸钠结晶只需轻轻地夹动密封塑料袋中带扭簧的金属夹,就 2020-12-03 …
水杨酸钠与氢离子的反应水杨酸钠与氢离子反应后生成什么物质?水杨酸钠结构简式是Ph-COONa|OH( 2020-12-14 …
下面是钠元素和氯元素在元素周期表中的信息和4种粒子的结构示意图.请回答下列问题:(1)氯元素的相对原 2021-01-20 …