早教吧作业答案频道 -->化学-->
含有氧族元素的物质群体十分庞大,回答下列问题.(1)基态18O原子中,能量最高的能级上电子运动状态共有种,有个未成对电子.(2)氧、硫元素均可形成两种氢化物:H2O、H2O2、H2S
题目详情
含有氧族元素的物质群体十分庞大,回答下列问题.
(1)基态18O原子中,能量最高的能级上电子运动状态共有___种,有___个未成对电子.
(2)氧、硫元素均可形成两种氢化物:H2O、H2O2、H2S、H2S2,其中属于V形分子的是___,H2O2、H2S2两种分子中,中心原子的杂化轨道类型是___.
(3)氧族元素形成的简单氢化物,水分子最稳定的本质原因是___,沸点最高与最低的两种物质分别是水与H2S,试解释其原因___.
(4)常温时氯化铬酰(CrO2Cl2)是易溶于CS2、CCl4的液体,则铬、氯、氧三种元素的第一电离能由大到小的顺序为___,CrO2Cl2的分子结构最可能是图1中的___.
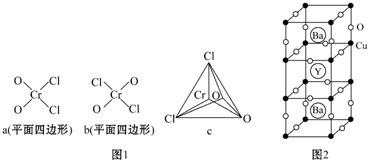
(5)图2为某种性能良好的金属氧化物超导体的晶胞结构.
①该超导体的化学式为___.
②若该超导体的密度为ρg•cm-3,则该晶胞的体积为___.
(1)基态18O原子中,能量最高的能级上电子运动状态共有___种,有___个未成对电子.
(2)氧、硫元素均可形成两种氢化物:H2O、H2O2、H2S、H2S2,其中属于V形分子的是___,H2O2、H2S2两种分子中,中心原子的杂化轨道类型是___.
(3)氧族元素形成的简单氢化物,水分子最稳定的本质原因是___,沸点最高与最低的两种物质分别是水与H2S,试解释其原因___.
(4)常温时氯化铬酰(CrO2Cl2)是易溶于CS2、CCl4的液体,则铬、氯、氧三种元素的第一电离能由大到小的顺序为___,CrO2Cl2的分子结构最可能是图1中的___.

(5)图2为某种性能良好的金属氧化物超导体的晶胞结构.
①该超导体的化学式为___.
②若该超导体的密度为ρg•cm-3,则该晶胞的体积为___.
▼优质解答
答案和解析
(1)18O原子中,2p上有4个电子,是四种不同的运动状态;核外电子排布是1s22s22p4,p轨道上4个电子占据三个轨道,则有两个未成对电子,
故答案为:4;2;
(2)H2O、H2O2、H2S、H2S2,四种分子中,硫、氧原子均形成了2个σ键、还有2个孤电子对,杂化轨道数目均为4,H2O、H2S均是V形分子,H2O2、H2S2两种分子中,中心原子的杂化轨道类型是sp3杂化,
故答案为:H2O、H2S;sp3杂化;
(3)分子的稳定性是由键能大小决定的,H-O键的键能比其他氢化物中的键能大,故水最稳当,
水分子间可以形成氢键而其他氢化物分子间不能形成氢键,故水的沸点最高,H2S分子间作用力最小,故沸点最低,
故答案为:H-O键的键能比其他氢化物中的键能大;水分子间可以形成氢键而其他氢化物分子间不能形成氢键,故水的沸点最高,H2S分子间作用力最小,故沸点最低;
(4)非金属性越强,第一电离能越大,第一电离能由大到小的顺序为:O>Cl>Cr,
由CrO2Cl2的溶解性及CCl4是非极性分子知,CrO2Cl2最可能是非极性分子,故其最可能的结构为b,
故答案为:O>Cl>Cr;b;
(5)①根据均摊法可知,在一个晶胞中含有钇原子数为1、钡原子数为2,铜原子数为8×
+8×
=3,氧原子数为8×
+12×
=7,故化学式为:YBa2Cu3O7,
故答案为:YBa2Cu3O7;
②化学式为YBa2Cu3O7,摩尔质量为667 g/mol,则晶胞质量为
g,故ρg•cm-3×V=
g,解得V=
cm3,
故答案为:
cm3.
故答案为:4;2;
(2)H2O、H2O2、H2S、H2S2,四种分子中,硫、氧原子均形成了2个σ键、还有2个孤电子对,杂化轨道数目均为4,H2O、H2S均是V形分子,H2O2、H2S2两种分子中,中心原子的杂化轨道类型是sp3杂化,
故答案为:H2O、H2S;sp3杂化;
(3)分子的稳定性是由键能大小决定的,H-O键的键能比其他氢化物中的键能大,故水最稳当,
水分子间可以形成氢键而其他氢化物分子间不能形成氢键,故水的沸点最高,H2S分子间作用力最小,故沸点最低,
故答案为:H-O键的键能比其他氢化物中的键能大;水分子间可以形成氢键而其他氢化物分子间不能形成氢键,故水的沸点最高,H2S分子间作用力最小,故沸点最低;
(4)非金属性越强,第一电离能越大,第一电离能由大到小的顺序为:O>Cl>Cr,
由CrO2Cl2的溶解性及CCl4是非极性分子知,CrO2Cl2最可能是非极性分子,故其最可能的结构为b,
故答案为:O>Cl>Cr;b;
(5)①根据均摊法可知,在一个晶胞中含有钇原子数为1、钡原子数为2,铜原子数为8×
| 1 |
| 8 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 4 |
故答案为:YBa2Cu3O7;
②化学式为YBa2Cu3O7,摩尔质量为667 g/mol,则晶胞质量为
| 667 |
| NA |
| 667 |
| NA |
| 667 |
| ρNA |
故答案为:
| 667 |
| ρNA |
看了含有氧族元素的物质群体十分庞大...的网友还看了以下:
庞然大物的“庞”是什么意思, 2020-03-30 …
庞然大物(庞)随心所欲(欲)和睦相处(睦)安然无恙(恙)括号中字的意思 2020-04-26 …
庞然大物的“庞”是什么意思? 2020-04-26 …
庞然大物的庞然是什么意思快快 2020-04-26 …
庞然大物的庞是什么意思 2020-04-26 …
初中文言文在线翻译明察秋毫的毫的意思与怡然自得的怡然的意思和庞然大物的庞的意思 2020-05-13 …
化学问题:氯化钡和硫酸反应……拜托了各位谢谢BaCl2+H2SO4=BaSO4↓+2HClAgNO 2020-05-14 …
阅读下面语段,完成习题。一种叫自养。绿色植物都属于这一类。它们自己把无机物制造成有机的食物,满足生 2020-05-17 …
解释词语中的字的意思络绎不绝的绝饱学之士的饱摩天大楼的摩喜怒无常的常顾名思义的顾知彼知己的己庞然大 2020-06-28 …
有关硫酸铜的结晶水合物的试题,谁会计算?1、硫酸铜的结晶水合物俗称胆矾或蓝矾,化学式CuSO45H 2020-07-29 …