早教吧作业答案频道 -->化学-->
硫代硫酸钠是一种重要的化工产品.工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程.烧瓶C中发生反应如下:Na2S(aq)+H2O(l)+SO2(g)=Na2SO
题目详情
硫代硫酸钠是一种重要的化工产品.工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程.
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)
Na2S2O3(aq) (Ⅲ)
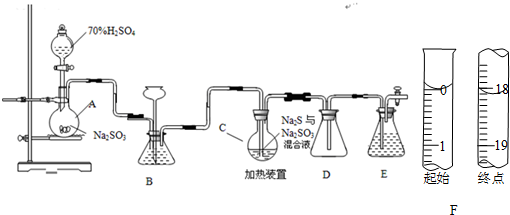
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若___,则整个装置气密性良好.装置D的作用是___.装置E中为___溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为___.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择___.
a.蒸馏水 b.饱和Na2SO3溶液c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)实验中,为使SO2缓慢进入烧瓶C,采用的操作是___.
(5)已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是___.
(6)反应终止后,烧瓶C中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有Na2S2O3•5H2O和其他杂质).某兴趣小组为测定该产品纯度,准确称取4.96 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L¯1碘的标准溶液滴定.反应原理为:2S2O32-+I2=S4O62-+2I¯,滴定至终点时,滴定起始和终点的液面位置如图,则产品的纯度为___.经仪器分析,该产品纯度为16%,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差)___.[M(Na2S2O3•5H2O)=248g/mol].

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)
| ||
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若___,则整个装置气密性良好.装置D的作用是___.装置E中为___溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为___.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择___.
a.蒸馏水 b.饱和Na2SO3溶液c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)实验中,为使SO2缓慢进入烧瓶C,采用的操作是___.
(5)已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是___.
(6)反应终止后,烧瓶C中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有Na2S2O3•5H2O和其他杂质).某兴趣小组为测定该产品纯度,准确称取4.96 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L¯1碘的标准溶液滴定.反应原理为:2S2O32-+I2=S4O62-+2I¯,滴定至终点时,滴定起始和终点的液面位置如图,则产品的纯度为___.经仪器分析,该产品纯度为16%,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差)___.[M(Na2S2O3•5H2O)=248g/mol].
▼优质解答
答案和解析
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,则气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用,可选用NaOH溶液,
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)装置A中反应的化学方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1,
故答案为:2:1;
(3)观察SO2的生成速率,是通过观察溶液中产生气泡的快慢来判断,所以溶液不能与SO2反应,选项中只有饱和NaHSO3溶液与二氧化硫不反应,
故答案为:c;
(4)分液漏斗有玻璃活塞,通过控制分液漏斗的活塞控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,
故答案为:控制滴加硫酸的速度;
(5)根据C中发生的反应可知,烧瓶C中反应达到终点发生反应为硫与亚硫酸钠反应生成硫代硫酸钠,反应的现象为溶液变澄清(或混浊消失),
故答案为:溶液变澄清(或浑浊消失);
(6)根据图示的滴定管中液面可知,滴定管中初始读数为0.00mL,滴定终点液面读数为18.10mL,所以消耗碘的标准溶液体积为18.10mL-0.00mL=18.10mL;
根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以4.96g产品中含有Na2S2O3•5H2O质量为:0.1000 mol•L-1×18.10×10-3L×2×248g/mol=0.89776g,故则产品的纯度为:
×100%=18.1%,经仪器分析,该产品纯度为16%,产品纯度测量值偏大,粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大,
故答案为:18.1%;粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大.
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)装置A中反应的化学方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1,
故答案为:2:1;
(3)观察SO2的生成速率,是通过观察溶液中产生气泡的快慢来判断,所以溶液不能与SO2反应,选项中只有饱和NaHSO3溶液与二氧化硫不反应,
故答案为:c;
(4)分液漏斗有玻璃活塞,通过控制分液漏斗的活塞控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,
故答案为:控制滴加硫酸的速度;
(5)根据C中发生的反应可知,烧瓶C中反应达到终点发生反应为硫与亚硫酸钠反应生成硫代硫酸钠,反应的现象为溶液变澄清(或混浊消失),
故答案为:溶液变澄清(或浑浊消失);
(6)根据图示的滴定管中液面可知,滴定管中初始读数为0.00mL,滴定终点液面读数为18.10mL,所以消耗碘的标准溶液体积为18.10mL-0.00mL=18.10mL;
根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以4.96g产品中含有Na2S2O3•5H2O质量为:0.1000 mol•L-1×18.10×10-3L×2×248g/mol=0.89776g,故则产品的纯度为:
| 0.89776g |
| 4.96g |
故答案为:18.1%;粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大.
看了硫代硫酸钠是一种重要的化工产品...的网友还看了以下:
用盐酸含量为18%和23%的盐酸溶液配制浓度为20%的盐酸溶液1000克,需要用盐酸含量为18%的 2020-05-15 …
为什么区分硫酸钡和碳酸钡 不能用硝酸 而要用盐酸 2020-05-16 …
为什么去除盐酸(盐类物质)要用碳酸钙不用碳酸钠?盐类物质就是指碳酸钠,碳酸钙去除的是渗入土壤中的盐 2020-05-16 …
如化学方程式 碳酸钙与盐酸反应制取二氧化碳 ,为什么非要用碳酸钙用碳酸钠不行吗? 2020-05-16 …
钼酸铅溶出水吗?最近要用钼酸铅配置铅离子标准溶液,不知该如何配置.看试剂瓶上写的钼酸铅是不溶于水的 2020-05-21 …
w我要买盐酸我的搪瓷贫漏了.用酒精耸香焊不了.听说要用盐酸锌.但不知到哪里去买.我所说的盐酸锌是以 2020-07-03 …
为什么铜的精炼中电解质溶液要用硫酸酸化比如说用硫酸酸化的硫酸铜溶液. 2020-11-01 …
点解要用硫酸才可将高锰酸钾酸化?而又不用硝酸or氢氯酸? 2020-11-03 …
在进行置换滴定硫代硫酸钠时为什么不直接用碘滴定而要用络酸钾氧化碘化钾成为碘再滴加硫代硫在进行置换滴定 2020-11-10 …
做晶间腐蚀4334.5标准敏化前和实验之前为什么不能用氯化物来去油和氧化铁皮如果要用硝酸和氢氟酸去油 2021-02-05 …