早教吧作业答案频道 -->化学-->
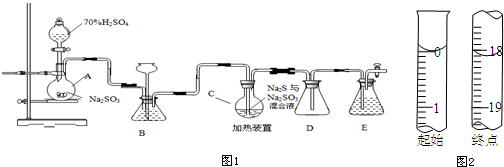
硫代硫酸钠是一种重要的化工产品.工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图1装置(略去部分加持仪器)模拟生成过程.烧瓶C中发生反应如下:Na2S(aq)+H2O(l)+SO2(g)=Na2S
题目详情
硫代硫酸钠是一种重要的化工产品.工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图1装置(略去部分加持仪器)模拟生成过程.
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若___,则整个装置气密性良好.装置D的作用是___.装置E中为___溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为___.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择___.
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)实验中,为使SO2缓慢进入烧瓶C,采用的操作是___.
(5)已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是___.
(6)反应终止后,烧瓶C中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有Na2S2O3•5H2O和其他杂质).某兴趣小组为测定该产品纯度,准确称取4.96 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L¯1碘的标准溶液滴定.反应原理为:2S2O32-+I2=S4O62-+2I¯,滴定至终点时,滴定起始和终点的液面位置如图2,则产品的纯度为___.经仪器分析,该产品纯度为16%,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差)___.[M(Na2S2O3•5H2O)=248g/mol].

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)
| ||
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若___,则整个装置气密性良好.装置D的作用是___.装置E中为___溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为___.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择___.
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)实验中,为使SO2缓慢进入烧瓶C,采用的操作是___.
(5)已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是___.
(6)反应终止后,烧瓶C中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有Na2S2O3•5H2O和其他杂质).某兴趣小组为测定该产品纯度,准确称取4.96 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L¯1碘的标准溶液滴定.反应原理为:2S2O32-+I2=S4O62-+2I¯,滴定至终点时,滴定起始和终点的液面位置如图2,则产品的纯度为___.经仪器分析,该产品纯度为16%,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差)___.[M(Na2S2O3•5H2O)=248g/mol].
▼优质解答
答案和解析
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,则气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用,可选用NaOH溶液,
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)装置A中反应的化学方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1,
故答案为:2:1;
(3)观察SO2的生成速率,是通过观察溶液中产生气泡的快慢来判断,所以溶液不能与SO2反应,选项中只有饱和NaHSO3溶液与二氧化硫不反应,
故答案为:c;
(4)分液漏斗有玻璃活塞,通过控制分液漏斗的活塞控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,
故答案为:控制滴加硫酸的速度;
(5)根据C中发生的反应可知,烧瓶C中反应达到终点发生反应为硫与亚硫酸钠反应生成硫代硫酸钠,反应的现象为溶液变澄清(或混浊消失),
故答案为:溶液变澄清(或浑浊消失);
(6)根据图示的滴定管中液面可知,滴定管中初始读数为0.00mL,滴定终点液面读数为18.10mL,所以消耗碘的标准溶液体积为18.10mL-0.00mL=18.10mL;
根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以4.96g产品中含有Na2S2O3•5H2O质量为:0.1000 mol•L-1×18.10×10-3L×2×248g/mol=0.89776g,故则产品的纯度为:
×100%=18.1%,经仪器分析,该产品纯度为16%,产品纯度测量值偏大,粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大,
故答案为:18.1%;粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大.
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)装置A中反应的化学方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1,
故答案为:2:1;
(3)观察SO2的生成速率,是通过观察溶液中产生气泡的快慢来判断,所以溶液不能与SO2反应,选项中只有饱和NaHSO3溶液与二氧化硫不反应,
故答案为:c;
(4)分液漏斗有玻璃活塞,通过控制分液漏斗的活塞控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,
故答案为:控制滴加硫酸的速度;
(5)根据C中发生的反应可知,烧瓶C中反应达到终点发生反应为硫与亚硫酸钠反应生成硫代硫酸钠,反应的现象为溶液变澄清(或混浊消失),
故答案为:溶液变澄清(或浑浊消失);
(6)根据图示的滴定管中液面可知,滴定管中初始读数为0.00mL,滴定终点液面读数为18.10mL,所以消耗碘的标准溶液体积为18.10mL-0.00mL=18.10mL;
根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以4.96g产品中含有Na2S2O3•5H2O质量为:0.1000 mol•L-1×18.10×10-3L×2×248g/mol=0.89776g,故则产品的纯度为:
| 0.89776g |
| 4.96g |
故答案为:18.1%;粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大.
看了硫代硫酸钠是一种重要的化工产品...的网友还看了以下:
每瓶矿泉水连瓶带水共重550克,倒出一半后,连瓶带水共重300克,这瓶水重多少克.谢每瓶矿泉水连瓶 2020-04-07 …
一瓶水正放和倒放对桌面压力有什么不同瓶盖面积较小,平底面积较大,水重、瓶重一定,但正放瓶对水有向下 2020-05-16 …
一空瓶,倒4杯水,瓶和水质量是520克,倒6杯水,瓶和水质量680克,一杯水重?克,瓶重?克 2020-05-24 …
用一个杯想:一杯水和一个空瓶各重多少克?用一个杯子像一个空瓶里倒水.如果到近3被水里,连瓶共重44 2020-06-04 …
有10瓶水,其中9瓶质量相等,有一瓶比其他的几瓶水略重一些.至少称几次,能保证找出这瓶水?有10瓶 2020-06-06 …
有一瓶水连瓶重820克,喝了一半后,连瓶重420克,瓶和水各重多少克?对吗水重x,瓶重yx+y=8 2020-06-14 …
一个装水的大瓶子,如果向瓶中倒3杯水,连瓶共重550克.如果向瓶中倒9杯水,连瓶共重850克.如果 2020-06-23 …
用一个杯子向空瓶里倒水,如果倒进3杯水,连瓶共重440g如果倒进7杯水,连瓶共重600g一杯水与. 2020-07-08 …
用一个杯子向空瓶里倒水.倒进瓶子3杯水,连瓶共重330克,倒进瓶子8杯水,连瓶共重580克.一杯水 2020-07-09 …
某品牌的洗发水,大瓶装的每瓶重450g,售价为36元;小瓶装的每瓶重150g,售价为12.5元.大 2020-07-30 …