早教吧作业答案频道 -->化学-->
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L.某化学小组同学设
题目详情
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
Ⅰ、测定原理:
碱性体积下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH-═2MnO(OH)2↓
酸性条件下,MnO(OH)2将I-氧化为I2:②MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)
用Na2S2O3标准溶液滴定生成的I2:③2S2O32-+I2═S4O62-+2I-
Ⅱ、测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2.
b.向烧瓶中加入200mL水样
c.向烧瓶中依次迅速加入1mLMnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全.
d.搅拌并向烧瓶中加入2mLH2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性.
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.001000mol/L Na2S2O3溶液进行滴定,记录数据.
f.…
g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化).
回答下列问题:
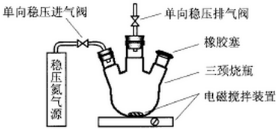
(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为___.
(2)在橡胶塞处加入水样及有关试剂应选择的仪器是___.
①滴定管②注射器③量筒
(3)搅拌的作用是___.
(4)配平反应②的方程式,其化学计量数依次为___.
(5)步骤f为___.
(6)步骤e中达到滴定终点的标志为___.若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=___mg/L(保留一位小数).作为饮用水源,此次测得DO是否达标:___(填“是”或“否”).
(7)步骤d中加入H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)___.
Ⅰ、测定原理:
碱性体积下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH-═2MnO(OH)2↓
酸性条件下,MnO(OH)2将I-氧化为I2:②MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)
用Na2S2O3标准溶液滴定生成的I2:③2S2O32-+I2═S4O62-+2I-
Ⅱ、测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2.
b.向烧瓶中加入200mL水样
c.向烧瓶中依次迅速加入1mLMnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全.
d.搅拌并向烧瓶中加入2mLH2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性.
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.001000mol/L Na2S2O3溶液进行滴定,记录数据.
f.…
g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化).
回答下列问题:

(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为___.
(2)在橡胶塞处加入水样及有关试剂应选择的仪器是___.
①滴定管②注射器③量筒
(3)搅拌的作用是___.
(4)配平反应②的方程式,其化学计量数依次为___.
(5)步骤f为___.
(6)步骤e中达到滴定终点的标志为___.若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=___mg/L(保留一位小数).作为饮用水源,此次测得DO是否达标:___(填“是”或“否”).
(7)步骤d中加入H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)___.
▼优质解答
答案和解析
(1)溶液中氧气溶解度不大,且随温度升高溶解度减小,所以配制以上无氧溶液时需要通过煮沸溶剂后冷却,把溶剂水中溶解的氧气赶出得到,
故答案为:将溶剂水煮沸后冷却;
(2)加入水样需要避免空气进入三颈瓶,橡皮塞处用中注射器把水样注入,在橡胶塞处加入水样及有关试剂应选择的仪器是②,滴定管和量筒无法实现加入水样的目的,
故答案为:②;
(3)操作步骤中搅拌的作用是使溶液混合均匀,快速完成反应,
故答案为:使溶液混合均匀,快速完成反应;
(4)MnO(OH)2+I-+H+→Mn2++I2+H2O,MnO(OH)2+I-+H+→Mn2++I2+H2O,反应中碘元素化合价-1价变化为0价,锰元素化合价降低+4价变化为+2价,电子转移总数2,配平得到离子方程式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O,
故答案为:1,2,4,1,1,3;
(5)为减少实验过程中的误差,滴定实验应重复进行滴定实验测定数值,取几次的平均值计算,步骤f为重复步骤e的操作2-3次,
故答案为:重复步骤e的操作2-3次;
(6)用Na2S2O3标准溶液滴定生成的I2发生反应2S2O32-+I2═S4O62-+2I-,以淀粉作指示剂,随硫代硫酸钠溶液滴入,滴定过程中滴入最后一滴溶液蓝色变化为无色且半分钟不变说明反应达到终点,若某次滴定消耗Na2S2O3溶液4.50mL,2Mn2++O2+4OH-═2MnO(OH)2↓,MnO(OH)2+2I-+4H+=Mn2++I2+3H2O,2S2O32-+I2═S4O62-+2I-,得到定量关系为:
O2~2MnO(OH)2~2I2~4S2O32-,
1 4
n 0.0045L×0.01000mol•L-1
n=1.12×10-5mol,
200mL水样中含氧气1.12×10-5mol×
=5.6×10-5mol
氧气浓度=
=2.8×10-4mol/L,
水中溶氧量(DO)=2.8×10-4mol/L×32g/mol=8.96×10-3g/L≈9.0mg/L>5 mg/L,生活饮用水源的DO不能低于5mg•L-1.则此水样符合标准,
故答案为:溶液蓝色褪去且半分钟内不变化;9.0;是;
(7)硫代硫酸钠在酸性条件下发生歧化反应,生成的二氧化硫也能够被生成的碘氧化,同时空气中的氧气也能够将碘离子氧化,反应的离子方程式分别为:2H++S2O32-=S↓+SO2↑+H2O;SO2+I2+2H2O=4H++SO42-+2I-;4H++4I-+O2=2I2+2H2O,
故答案为:2H++S2O32-=S↓+SO2↑+H2O,SO2+I2+2H2O=4H++SO42-+2I-,4H++4I-+O2=2I2+2H2O.
故答案为:将溶剂水煮沸后冷却;
(2)加入水样需要避免空气进入三颈瓶,橡皮塞处用中注射器把水样注入,在橡胶塞处加入水样及有关试剂应选择的仪器是②,滴定管和量筒无法实现加入水样的目的,
故答案为:②;
(3)操作步骤中搅拌的作用是使溶液混合均匀,快速完成反应,
故答案为:使溶液混合均匀,快速完成反应;
(4)MnO(OH)2+I-+H+→Mn2++I2+H2O,MnO(OH)2+I-+H+→Mn2++I2+H2O,反应中碘元素化合价-1价变化为0价,锰元素化合价降低+4价变化为+2价,电子转移总数2,配平得到离子方程式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O,
故答案为:1,2,4,1,1,3;
(5)为减少实验过程中的误差,滴定实验应重复进行滴定实验测定数值,取几次的平均值计算,步骤f为重复步骤e的操作2-3次,
故答案为:重复步骤e的操作2-3次;
(6)用Na2S2O3标准溶液滴定生成的I2发生反应2S2O32-+I2═S4O62-+2I-,以淀粉作指示剂,随硫代硫酸钠溶液滴入,滴定过程中滴入最后一滴溶液蓝色变化为无色且半分钟不变说明反应达到终点,若某次滴定消耗Na2S2O3溶液4.50mL,2Mn2++O2+4OH-═2MnO(OH)2↓,MnO(OH)2+2I-+4H+=Mn2++I2+3H2O,2S2O32-+I2═S4O62-+2I-,得到定量关系为:
O2~2MnO(OH)2~2I2~4S2O32-,
1 4
n 0.0045L×0.01000mol•L-1
n=1.12×10-5mol,
200mL水样中含氧气1.12×10-5mol×
| 200 |
| 40 |
氧气浓度=
| 5.6×10-5mol |
| 0.2L |
水中溶氧量(DO)=2.8×10-4mol/L×32g/mol=8.96×10-3g/L≈9.0mg/L>5 mg/L,生活饮用水源的DO不能低于5mg•L-1.则此水样符合标准,
故答案为:溶液蓝色褪去且半分钟内不变化;9.0;是;
(7)硫代硫酸钠在酸性条件下发生歧化反应,生成的二氧化硫也能够被生成的碘氧化,同时空气中的氧气也能够将碘离子氧化,反应的离子方程式分别为:2H++S2O32-=S↓+SO2↑+H2O;SO2+I2+2H2O=4H++SO42-+2I-;4H++4I-+O2=2I2+2H2O,
故答案为:2H++S2O32-=S↓+SO2↑+H2O,SO2+I2+2H2O=4H++SO42-+2I-,4H++4I-+O2=2I2+2H2O.
看了水中溶氧量(DO)是衡量水体自...的网友还看了以下:
如图,是大自然中水循环现象的示意图.江、河、湖、海以及大地表层中的水不断蒸发变成水蒸气.当含有很多 2020-05-17 …
如图是大自然中水循环现象的示意图.江、河、湖、海以及大地表面层中的水不断蒸发变成水蒸气,当含有很多 2020-05-17 …
如图是大自然中水循环现象的示意图.江、河、湖、海以及大地表层中的水不断蒸发变成水蒸气.当含有很多水 2020-05-17 …
如图是大自然中水循环现象的示意图.江、河、湖、海以及大地表层中的水不断蒸发变成水蒸气.当含有很多水 2020-05-17 …
如图是大自然中水循环现象的示意图。江、河、湖、海以及大地表层中的水不断蒸发变成水蒸气。当含有很多水 2020-05-17 …
如图是大自然中水循环现象的艰示意图.江、河、湖、海以及大地表层中的水不断蒸发变成水蒸气.当含有很多 2020-05-17 …
如图1是大自然中水循环现象的示意图.江、河、湖、海以及大地表层中的水不断蒸发变成水蒸气.当含有很多 2020-05-17 …
如图所示是大自然中水循环现象的示意图.江、河、湖、海以及大地表层中的水不断蒸发变成水蒸气.当含有很 2020-05-17 …
如图1是大自然中水循环现象的示意图.江、河、湖、海以及大地表层中的水不断蒸发变成水蒸气.当含有很多 2020-05-17 …
书中说结合水占细胞中总水量的4.5%.但是我在一些题中都发现了这样一道题.在晒干的大豆中有15%的 2020-05-23 …