早教吧作业答案频道 -->化学-->
氯及其化合物广泛存在于自然界中,回答下列问题:(1)在基态氯原子中,排布电子的原子轨道数为个,其价电子层中存在对自旋相反的电子.(2)四氯化碳与水不互溶发生分层,四
题目详情
氯及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态氯原子中,排布电子的原子轨道数为___个,其价电子层中存在___对自旋相反的电子.
(2)四氯化碳与水不互溶发生分层,四氯化硅与四氯化碳分子结构相似,但遇水极易发生水解反应,导致二者性质不同的原因是___.
(3)熔融时氯化铝生成可挥发的二聚体Al2Cl6,其分子中存在的化学键的类型有___,Al原子的杂化轨道类型是___;更高温度时二聚体离解生成AlCl3(与BF3结构类似),其分子空间构型为___.
(4)四种卤化物:NaF、CsCl、HF、HCl,其熔点从高到低的顺序为___.
(5)CuCl中基态Cu+的价层电子排布式为___,其晶体与闪锌矿相似,晶胞中氯原子分别位于面心和顶点,则位于晶胞内部的Cu原子有___个.其晶胞参数a=x nm,列式表示CuCl晶体的密度___g•cm-3(不必计算出结果).
(1)在基态氯原子中,排布电子的原子轨道数为___个,其价电子层中存在___对自旋相反的电子.
(2)四氯化碳与水不互溶发生分层,四氯化硅与四氯化碳分子结构相似,但遇水极易发生水解反应,导致二者性质不同的原因是___.
(3)熔融时氯化铝生成可挥发的二聚体Al2Cl6,其分子中存在的化学键的类型有___,Al原子的杂化轨道类型是___;更高温度时二聚体离解生成AlCl3(与BF3结构类似),其分子空间构型为___.
(4)四种卤化物:NaF、CsCl、HF、HCl,其熔点从高到低的顺序为___.
(5)CuCl中基态Cu+的价层电子排布式为___,其晶体与闪锌矿相似,晶胞中氯原子分别位于面心和顶点,则位于晶胞内部的Cu原子有___个.其晶胞参数a=x nm,列式表示CuCl晶体的密度___g•cm-3(不必计算出结果).
▼优质解答
答案和解析
(1)基态氯原子原子核外电子排布为1s22s22p63s23p5,每一个s能级有1个轨道,p能级有3个轨道,氯原子原子轨道数为9,其核外存在3对自旋相反的电子;
故答案为:9;3;
(2)硅原子有3d空轨道,而碳原子没有2d空轨道也就没有d空轨道,不能接受氧原子的孤对电子,即不能形成配位键,与水分子间的作用力小,不能反应,所以四硅化碳能水解而四氯化碳不能水解;
故答案为:硅原子有3d空轨道,而碳原子没有d空轨道(因为没有2d轨道),不能接受氧原子的孤对电子,所以四硅化碳能水解而四氯化碳不能水解;
(3)铝原子和氯原子之间形成共价键,还形成一个配位键,其结构为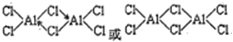 ,氯化铝中每个铝原子含有3个共价键,且不含孤电子对,为平面三角形结构,缔合双分子Al2Cl6中Al原子的轨道杂化类型sp3,
,氯化铝中每个铝原子含有3个共价键,且不含孤电子对,为平面三角形结构,缔合双分子Al2Cl6中Al原子的轨道杂化类型sp3,
故答案为:共价键和配位键;sp3;平面三角形;
(4)结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高,为NaF>CsCl,HF存在氢键,沸点大于HCl的,为HF>HCl,离子晶体的熔点大于分子晶体的熔点,即NaF>CsCl>HF>HCl;
故答案为:NaF>CsCl>HF>HCl;
(5)Cu为29号元素,属于第4周期第ⅠB族元素,Cu的价层电子排布式为3d104s1,Cu+的价层电子排布式为3d10;CuCl晶胞中氯原子分别位于面心和顶点,则Cl原子的数目为6×
+8×
=4,CuCl中Cu与Cl原子数目之比为1:1,则位于晶胞内部的Cu原子有4个,晶胞参数a=x nm=x×10-7cm,晶胞体积V=a3cm3,晶胞质量m=
g,则CuCl晶体的密度ρ=
=
.
故答案为:
.
故答案为:9;3;
(2)硅原子有3d空轨道,而碳原子没有2d空轨道也就没有d空轨道,不能接受氧原子的孤对电子,即不能形成配位键,与水分子间的作用力小,不能反应,所以四硅化碳能水解而四氯化碳不能水解;
故答案为:硅原子有3d空轨道,而碳原子没有d空轨道(因为没有2d轨道),不能接受氧原子的孤对电子,所以四硅化碳能水解而四氯化碳不能水解;
(3)铝原子和氯原子之间形成共价键,还形成一个配位键,其结构为
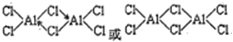 ,氯化铝中每个铝原子含有3个共价键,且不含孤电子对,为平面三角形结构,缔合双分子Al2Cl6中Al原子的轨道杂化类型sp3,
,氯化铝中每个铝原子含有3个共价键,且不含孤电子对,为平面三角形结构,缔合双分子Al2Cl6中Al原子的轨道杂化类型sp3,故答案为:共价键和配位键;sp3;平面三角形;
(4)结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高,为NaF>CsCl,HF存在氢键,沸点大于HCl的,为HF>HCl,离子晶体的熔点大于分子晶体的熔点,即NaF>CsCl>HF>HCl;
故答案为:NaF>CsCl>HF>HCl;
(5)Cu为29号元素,属于第4周期第ⅠB族元素,Cu的价层电子排布式为3d104s1,Cu+的价层电子排布式为3d10;CuCl晶胞中氯原子分别位于面心和顶点,则Cl原子的数目为6×
| 1 |
| 2 |
| 1 |
| 8 |
| 64×4+35.5×4 |
| NA |
| m |
| V |
| 398 |
| NA×(x×10-7)3 |
故答案为:
| 398 |
| NA×(x×10-7)3 |
看了氯及其化合物广泛存在于自然界中...的网友还看了以下:
花生是我们黄岛区普遍栽种的农作物之一,如图四幅图表示的是花生的一生中几个主要阶段,请据图回答问题. 2020-05-13 …
恒星的一生中几个阶段描述并比较它们的密度大小、体积大小、亮度大小最好再传有关宇宙起源、太阳系形成、 2020-05-17 …
(7分)花生是我们黄冈市普遍栽种的农作物之一,下面四幅图表示的是花生的一生中几个主要阶段,请据图回 2020-06-11 …
湖南省很多地区民俗常常用花生、芝麻、茶叶打擂茶.花生是我省普遍栽种的农作物之一.如图四幅图表示的是 2020-06-11 …
我区期末考试数学学科的考试成绩以等级公布,某校所有考生成绩按由高到低分为优(A)、良(B)、中(c 2020-06-22 …
花生是我市普遍栽种的农作物之一,下面四幅图表示的是花生的一生中几个主要阶段,请据图回答问题.(1) 2020-07-16 …
花生是我们新泰普遍栽种的农作物之一,下面四幅图表示的是花生的一生中几个主要阶段,请据图回答问题.( 2020-07-16 …
甲乙丙三个学生,一个出生在南京,一个出生在北京,一个出生在上海,在这三个学生中,一个爱好数学,一个爱 2020-11-02 …
(2014•黄冈)花生是我们黄冈市普遍栽种的农作物之一,如图四幅图表示的是花生的一生中几个主要阶段, 2020-11-12 …
如何理解龙应台的"人生中一个决定牵动另一个决定,一个偶然注定另一个偶然,因此偶然从来不“人生中一个决 2020-11-22 …