早教吧作业答案频道 -->化学-->
2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一.(1)用CH4催化还原氮氧化物可以消除
题目详情
2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574.0KJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160.0KJ•mol-1
③H2O(g)═H2O(l)△H=-44.0KJ•mol-1
则:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=___.
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)⇌N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
①下列说法不能作为判断该反应达到化学平衡状态标志的是___
A.活性炭的质量 B.v正(N2)=2v逆(NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
②在T0C时,该反应的平衡常数为___(小数点后保留两位有效数字);
③在50min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原
来的两倍,则化学平衡___(填“正向移动”、“逆向移动”或“不移动”)
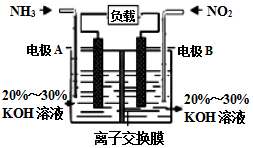
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.
①A电极的电极反应式为___
②下列关于该电池的说法正确的是___.
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol.

(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574.0KJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160.0KJ•mol-1
③H2O(g)═H2O(l)△H=-44.0KJ•mol-1
则:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=___.
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)⇌N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
物质 浓度(mol/L) 时间(min) | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
A.活性炭的质量 B.v正(N2)=2v逆(NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
②在T0C时,该反应的平衡常数为___(小数点后保留两位有效数字);
③在50min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原
来的两倍,则化学平衡___(填“正向移动”、“逆向移动”或“不移动”)
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.
①A电极的电极反应式为___
②下列关于该电池的说法正确的是___.
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol.
▼优质解答
答案和解析
(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574.0kJ•mol-l
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2 O(g)△H=-1160.0kJ•mol-l
③H2O(g)═H2O(l)△H=-44.0kJ•mol-l
依据盖斯定律计算[①+②+③×4]×
得到CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955.0 kJ•mol-1,
故答案为:-955.0 kJ•mol-1;
(2)①C(s)+2NO(g)⇌N2(g)+CO2(g),反应是气体体积不变的反应.
A.活性炭的质量保持不变说明达到平衡状态,故A不选;
B.反应速率之比等于化学方程式系数之比,当v正(N2)=2v逆(NO),不能说明反应达到平衡,当2v正(N2)=v逆(NO)则能说明达平衡,故B可选;
C.反应是气体体积不变的反应,反应过程中压强始终不变,所以容器内压强保持不变不能说明反应达到平衡,故C可选;
D.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变时,说明反应达到平衡,故D不选;
E.混合气体的平均相对分子质量等于气体总质量除以总物质的量,反应中碳是固体,平衡移动,气体质量发生变化,气体物质的量不变,混合气体的平均相对分子质量保持不变时,说明反应达到平衡状态,故E不选;
故答案为:BC;
②20-30min反应达到平衡状态,C(s)+2NO(g)⇌N2 (g)+CO2 (g),各物质的平衡浓度为:c(CO2)=c(N2)=0.030mol/L;c(NO)=0.040mol/L,反应的平衡常数为:K=
=
=0.56,
故答案为:0.56;
③在50min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则此时Qc=
=
=0.28<K=0.56,则化学平衡正向移动,
故答案为:正向移动;
(3)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极电极方程式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O;
②由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极发生氧化反应,正极发生还原反应.
A.电子从负极流出,正极流入,则电子从左侧电极经过负载后流向右侧电极,故A错误;
B.原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,故B正确;
C.根据总反应可知反应生成水,电解质溶液的碱性减弱,pH减小,故C错误;
D.不是标准状况下无法计算NO2的物质的量及转移电子的物质的量,故D错误;
故答案为:B.
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2 O(g)△H=-1160.0kJ•mol-l
③H2O(g)═H2O(l)△H=-44.0kJ•mol-l
依据盖斯定律计算[①+②+③×4]×
| 1 |
| 2 |
故答案为:-955.0 kJ•mol-1;
(2)①C(s)+2NO(g)⇌N2(g)+CO2(g),反应是气体体积不变的反应.
A.活性炭的质量保持不变说明达到平衡状态,故A不选;
B.反应速率之比等于化学方程式系数之比,当v正(N2)=2v逆(NO),不能说明反应达到平衡,当2v正(N2)=v逆(NO)则能说明达平衡,故B可选;
C.反应是气体体积不变的反应,反应过程中压强始终不变,所以容器内压强保持不变不能说明反应达到平衡,故C可选;
D.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变时,说明反应达到平衡,故D不选;
E.混合气体的平均相对分子质量等于气体总质量除以总物质的量,反应中碳是固体,平衡移动,气体质量发生变化,气体物质的量不变,混合气体的平均相对分子质量保持不变时,说明反应达到平衡状态,故E不选;
故答案为:BC;
②20-30min反应达到平衡状态,C(s)+2NO(g)⇌N2 (g)+CO2 (g),各物质的平衡浓度为:c(CO2)=c(N2)=0.030mol/L;c(NO)=0.040mol/L,反应的平衡常数为:K=
| c(CO2)•c(N2) |
| c2(NO) |
| 0.030×0.030 |
| 0.0402 |
故答案为:0.56;
③在50min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则此时Qc=
| c(CO2)•c(N2) |
| c2(NO) |
| 0.034×2×0.017 |
| (0.032×2)2 |
故答案为:正向移动;
(3)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极电极方程式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O;
②由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极发生氧化反应,正极发生还原反应.
A.电子从负极流出,正极流入,则电子从左侧电极经过负载后流向右侧电极,故A错误;
B.原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,故B正确;
C.根据总反应可知反应生成水,电解质溶液的碱性减弱,pH减小,故C错误;
D.不是标准状况下无法计算NO2的物质的量及转移电子的物质的量,故D错误;
故答案为:B.
看了2017年春节,京津冀及周边区...的网友还看了以下:
重G=500N的物体放在水平地面上,物体与地面间的动摩擦因数为μ=0.3.如图所示,当用F1=18 2020-04-09 …
关于运动物体的轨迹与所受合外力的关系,下列叙述正确的是()A.受恒力作用的物体一定做直线运动B.做 2020-04-26 …
求比值 15:60,22:3分之2,0.6:1.5,1.5小时:30分化成最简整数 45:60 2020-05-16 …
有甲乙两船,甲船和漂流物同时由A地向B地行,乙船也同时从B地向A地行.甲船行3小时后与漂流物相距6 2020-06-20 …
唐律规定:“诸市司评物价不平者,计所贵贱,坐赃论;入己者,以盗论。”“诸造器用之物及绢布之属,有行 2020-06-21 …
朱熹看到山石中有贝壳,认为“此石即旧日之土,螺蚌即水中之物,下者却变而为高,柔者却变而为刚”。这体 2020-06-25 …
如图是某物质加热时温度随时间变化的图象.下列对图象的分析正确的是()A.该物质一定是晶体B.T2一 2020-07-06 …
计算地方区时之差区时之差已知北京东经116度纽约西经73度北京时间为2011.5.1上午8点求①地 2020-07-08 …
动物的运动方式多种多样,下列关于运动方式的叙述正确的是()A.陆生动物中只有鸟和昆虫能飞行B.一种动 2020-12-14 …
一、列式计算.1、从1里面减去7分之6,再加上14分之1,结果是多少?2、一个数的5倍加上3.2,和 2020-12-17 …