早教吧作业答案频道 -->化学-->
工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:压强/MpaNH3含量/%温度/℃0.11020306010020015.
题目详情
工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
(1)根据表中数据并应用化学平衡移动原理,分析为提高平衡混合物中NH3的含量可采取的措施是___(多选或选错均不给分)
A.增大压强 B.减小压强
C.提高温度 D.降低温度
(2)根据表中数据,画出在30MPa下,NH3的百分含量随温度的变化曲线图. 在实际生产中,控制温度在
500℃左右,其原因是___.
(3)若生产1mol NH3时放出46.2kJ热量,写出合成氨的热化学方程式___.
(4)在500℃、30MPa条件下反应达到平衡时H2的转化率为___;若在某条件下平衡混合物中NH3的百分含量为a%,原混合气体与平衡混合气体的总物质的量之比为___(用含a的代数式表示).
| 压强/Mpa NH3含量/% 温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
A.增大压强 B.减小压强
C.提高温度 D.降低温度
(2)根据表中数据,画出在30MPa下,NH3的百分含量随温度的变化曲线图. 在实际生产中,控制温度在
500℃左右,其原因是___.
(3)若生产1mol NH3时放出46.2kJ热量,写出合成氨的热化学方程式___.
(4)在500℃、30MPa条件下反应达到平衡时H2的转化率为___;若在某条件下平衡混合物中NH3的百分含量为a%,原混合气体与平衡混合气体的总物质的量之比为___(用含a的代数式表示).

▼优质解答
答案和解析
(1)看表的横行可知,在温度相同时,随着压强的增大,平衡混合物中氨的体积分数逐渐增大,压强增大平衡正向移动,说明正反应是一个分子数减小的反应,表格的纵行可知,在压强相同时,随着温度的升高,平衡混合物中氨的体积分数逐渐减小,平衡逆向移动,说明合成氨的反应是放热反应,故选:AD;
(2)根据表格中的数据作图,用描点法: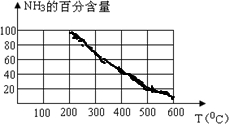 ,使用催化剂也能增大反应速率,但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度,故答案为:
,使用催化剂也能增大反应速率,但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度,故答案为: ;该温度时,催化剂的活性最大,有利于增大反应速率,提高产量;
;该温度时,催化剂的活性最大,有利于增大反应速率,提高产量;
(3)生成2mol氨气放热92.4KJ,反应为放热反应,反应的焓变为-92.4KJ/mol,反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g),△H=-92.4KJ/mol;
故答案为:N2(g)+3H2(g)=2NH3(g),△H=-92.4KJ/mol;
(4)N2(g)+3H2(g)=2NH3(g),
初起:1mol 3mol 0
变化:amol 3amol 2amol
平衡:(1-a)mol (3-3a)mol 2amol
此时氨的百分含量为:
=26.4,解之得a=0.42,所以达到平衡时H2的转化率为
×100%=42%;
N2(g)+3H2(g)=2NH3(g),
初起:1mol 3mol 0
变化:xmol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
由平衡混合物中NH3的百分含量为a%,则
=a%,解之得x=
,所以原混合气体与平衡混合气体的总物质的量之比为4:(4-
)=
,
故答案为:42%;
.
(2)根据表格中的数据作图,用描点法:
 ,使用催化剂也能增大反应速率,但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度,故答案为:
,使用催化剂也能增大反应速率,但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度,故答案为: ;该温度时,催化剂的活性最大,有利于增大反应速率,提高产量;
;该温度时,催化剂的活性最大,有利于增大反应速率,提高产量;(3)生成2mol氨气放热92.4KJ,反应为放热反应,反应的焓变为-92.4KJ/mol,反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g),△H=-92.4KJ/mol;
故答案为:N2(g)+3H2(g)=2NH3(g),△H=-92.4KJ/mol;
(4)N2(g)+3H2(g)=2NH3(g),
初起:1mol 3mol 0
变化:amol 3amol 2amol
平衡:(1-a)mol (3-3a)mol 2amol
此时氨的百分含量为:
| 2a |
| 4-2a |
| 0.42×3 |
| 3 |
N2(g)+3H2(g)=2NH3(g),
初起:1mol 3mol 0
变化:xmol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
由平衡混合物中NH3的百分含量为a%,则
| 2x |
| 4-2x |
| 2a |
| 100+a |
| 4a |
| 100+a |
| 100+a |
| 100 |
故答案为:42%;
| 100+a |
| 100 |
看了工业合成氨时将N2和H2按体积...的网友还看了以下: