早教吧作业答案频道 -->化学-->
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.(1)写出氯碱工业中电解饱和食盐水的离子方程式:.(2)
题目详情
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.
(1)写出氯碱工业中电解饱和食盐水的离子方程式:___.
(2)①室温下,0.1mol•L-1NaClO溶液的pH___ 0.1mol•L-1 Na2SO3溶液的pH.(填“大于”、“小于”或“等于”)已知:H2SO3的Ka1=1.54×10-2,Ka2=1.02×10-7;HClO的Ka=2.95×10-8
②写出一种可以证明NaHSO3溶液中HSO3-的电离程度大于HSO3-水解程度的方法:___
(3)常温下,饱和氯水中,存在反应Cl2+H2O⇌HCl+HClO.下列有关叙述正确的是___(填字母).
A.饱和氯水中只存在HClO的电离平衡
B.饱和氯水中:[H+]=[Cl-]+[ClO-]+[OH-]
C.往饱和氯水中加水,HClO 的电离程度减小
D.用氯气处理饮用水时,在夏季的杀菌效果比在冬季好
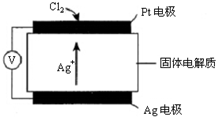
(4)氯气含量检测仪中,原电池工作原理示意图如图:则Cl2在Pt电极放电的电极反应为___.
(5)工业上用NaClO3氧化酸性FeCl2废液,通过控制条件,使Fe3+水解产物聚合,形成可溶的多聚体,
最终析出红棕色胶状沉淀Fe2O3•nH2O.其中水解形成羟桥配离子的离子方程式为:
2Fe3++10H2O⇌[Fe(H2O)4 (OH)2 Fe(H2O)4]4++2H+.
欲使上述水解平衡正向移动,可采用的方法有___(填字母).
A.加水稀释 B.加热 C.加入盐酸 D.加入NaHCO3
(6)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含CN-相同量的电镀废水,所需Cl2的质量是ClO2的___ 倍.(保留三位有效数字)

(1)写出氯碱工业中电解饱和食盐水的离子方程式:___.
(2)①室温下,0.1mol•L-1NaClO溶液的pH___ 0.1mol•L-1 Na2SO3溶液的pH.(填“大于”、“小于”或“等于”)已知:H2SO3的Ka1=1.54×10-2,Ka2=1.02×10-7;HClO的Ka=2.95×10-8
②写出一种可以证明NaHSO3溶液中HSO3-的电离程度大于HSO3-水解程度的方法:___
(3)常温下,饱和氯水中,存在反应Cl2+H2O⇌HCl+HClO.下列有关叙述正确的是___(填字母).
A.饱和氯水中只存在HClO的电离平衡
B.饱和氯水中:[H+]=[Cl-]+[ClO-]+[OH-]
C.往饱和氯水中加水,HClO 的电离程度减小
D.用氯气处理饮用水时,在夏季的杀菌效果比在冬季好
(4)氯气含量检测仪中,原电池工作原理示意图如图:则Cl2在Pt电极放电的电极反应为___.
(5)工业上用NaClO3氧化酸性FeCl2废液,通过控制条件,使Fe3+水解产物聚合,形成可溶的多聚体,
最终析出红棕色胶状沉淀Fe2O3•nH2O.其中水解形成羟桥配离子的离子方程式为:
2Fe3++10H2O⇌[Fe(H2O)4 (OH)2 Fe(H2O)4]4++2H+.
欲使上述水解平衡正向移动,可采用的方法有___(填字母).
A.加水稀释 B.加热 C.加入盐酸 D.加入NaHCO3
(6)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含CN-相同量的电镀废水,所需Cl2的质量是ClO2的___ 倍.(保留三位有效数字)
▼优质解答
答案和解析
(1)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(2)①H2SO3的Ka1=1.54×10-2,Ka2=1.02×10-7;HClO的Ka=2.95×10-8,H2SO3的无论一级电离、二级电离都大于次氯酸的电离,所以NaClO溶液的水解程度大于亚硫酸钠,即碱性强于亚硫酸钠溶液,
故答案为:大于;
②NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,用pH试纸(或pH计)测定NaHSO3溶液的酸碱性,测得溶液的pH<7,
故答案为:用pH试纸(或pH计)测定NaHSO3溶液的酸碱性,测得溶液的pH<7;
(3)A.饱和氯水中存在平衡:Cl2+H2O⇌HCl+HClO,HClO⇌H++ClO-、H2O⇌H++OH-,故A错误;
B.溶液中阳离子所带的正电荷总数等于阴离子所带的负电荷总数,[H+]=[Cl-]+[ClO-]+[OH-],故B正确;
C.Cl2+H2O⇌HCl+HClO,HClO⇌H++ClO-、往饱和氯水中加水,HCl浓度减小,C(H+)减少,促进次氯酸的电离,所以HClO的电离程度变大,故C错误;
D.夏季相比冬季温度高,HClO易分解,所以杀菌效果不如冬季,故D错误;
故选B;
(4)Cl2在Pt电极放电,生成AgCl,电极反应为:Cl2+2Ag++2e-=2AgCl,
故答案为:Cl2+2Ag++2e-=2AgCl;
(5)控制条件使平衡正向移动,使平衡正向移动,因为水解为吸热反应,所以加热,平衡正向移动;加水稀释,则水解平衡也正向移动;加入盐酸溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,故A、B、D符合条件,
故答案为:A、B、D;
(6)设质量都是71g,氯气得到的电子数为
×2×1=2mol,
ClO2得到的电子数为
×1×5=
mol,
则处理含CN-相同量的电镀废水,所需Cl2的质量是ClO2的比为:2.63:1=2.63,
故答案为:2.63.
| ||
故答案为:2Cl-+2H2O
| ||
(2)①H2SO3的Ka1=1.54×10-2,Ka2=1.02×10-7;HClO的Ka=2.95×10-8,H2SO3的无论一级电离、二级电离都大于次氯酸的电离,所以NaClO溶液的水解程度大于亚硫酸钠,即碱性强于亚硫酸钠溶液,
故答案为:大于;
②NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,用pH试纸(或pH计)测定NaHSO3溶液的酸碱性,测得溶液的pH<7,
故答案为:用pH试纸(或pH计)测定NaHSO3溶液的酸碱性,测得溶液的pH<7;
(3)A.饱和氯水中存在平衡:Cl2+H2O⇌HCl+HClO,HClO⇌H++ClO-、H2O⇌H++OH-,故A错误;
B.溶液中阳离子所带的正电荷总数等于阴离子所带的负电荷总数,[H+]=[Cl-]+[ClO-]+[OH-],故B正确;
C.Cl2+H2O⇌HCl+HClO,HClO⇌H++ClO-、往饱和氯水中加水,HCl浓度减小,C(H+)减少,促进次氯酸的电离,所以HClO的电离程度变大,故C错误;
D.夏季相比冬季温度高,HClO易分解,所以杀菌效果不如冬季,故D错误;
故选B;
(4)Cl2在Pt电极放电,生成AgCl,电极反应为:Cl2+2Ag++2e-=2AgCl,
故答案为:Cl2+2Ag++2e-=2AgCl;
(5)控制条件使平衡正向移动,使平衡正向移动,因为水解为吸热反应,所以加热,平衡正向移动;加水稀释,则水解平衡也正向移动;加入盐酸溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,故A、B、D符合条件,
故答案为:A、B、D;
(6)设质量都是71g,氯气得到的电子数为
| 71g |
| 71g/mol |
ClO2得到的电子数为
| 71g |
| 67.5g/mol |
| 71 |
| 13.5 |
则处理含CN-相同量的电镀废水,所需Cl2的质量是ClO2的比为:2.63:1=2.63,
故答案为:2.63.
看了 氯碱工业以电解精制饱和食盐水...的网友还看了以下:
从海水中提取一些重要的化工产品的工艺流程如图所示.根据上述流程图回答下列问题:(1)图中A的化学式 2020-05-02 …
阅读短文,回答问题:空调热水器空调热水器,又名空气能热泵热水器.其工作原理示意图如图所示.工作过程 2020-05-15 …
海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.(1)海水中制得的氯化钠可用于生产烧碱 2020-05-17 …
海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.(1)海水中制得的氯化钠可用于生产烧碱 2020-05-17 …
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:(1)步骤③的离子方程式:。( 2020-06-18 …
空气吹出法工艺,是目前“海水提溴”的最主要方法之一.以海水提盐后得到的苦卤为原料,提溴的工艺流程如 2020-07-15 …
空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:(1)步骤②发生反应的离子方程 2020-07-24 …
还原铁粉是冶金工业的重要原料,利用绿矾制备还原铁粉的工业流程如下:干燥过程主要是为了脱去游离水和结 2020-07-28 …
工业尾气硫化氢(H2S)是一种有毒气体,溶于水成为氢硫酸(H2S),目前采用氢氧化钠溶液吸收可以减少 2020-11-03 …
在四冲程汽油机的工作过程中,通过做功增加燃料混合物内能的是冲程;为了不让汽油机在工作时温度升得太高, 2020-12-05 …