早教吧作业答案频道 -->化学-->
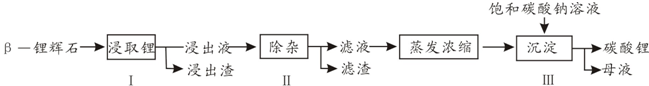
(2010?广东)碳酸锂广泛应用于陶瓷和医药等领域.已β-锂辉石(主要成分为Li2O-Al2O3-4SiO2)为原材料制备Li2CO3的工艺流程如下:已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式
题目详情
(2010?广东)碳酸锂广泛应用于陶瓷和医药等领域.已β-锂辉石(主要成分为Li 2 O-Al 2 O 3 -4SiO 2 )为原材料制备Li 2 CO 3 的工艺流程如下:
已知:Fe 3+ 、Al 3+ 、Fe 2+ 和Mg 2+ 以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li 2 SO 4 、LiOH和Li 2 CO 3 在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,B-锂辉石要粉碎成细颗粒的目的是 ____ .
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li + 、SO 4 2- ,另含有Al 3+ 、Fe 3+ 、Fe 2+ 、Mg 2+ 、Ca 2+ 、Na + 等杂质,需在搅拌下加入 ____ (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液.
(3)步骤2中,将适量的H 2 O 2 溶液、石灰乳和Na 2 CO 3 溶液依次加入浸出液中,可除去的杂质金属离子有
(4)步骤3中,生成沉淀的离子方程为
(5)从母液中可回收的主要物质是

已知:Fe 3+ 、Al 3+ 、Fe 2+ 和Mg 2+ 以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li 2 SO 4 、LiOH和Li 2 CO 3 在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,B-锂辉石要粉碎成细颗粒的目的是 ____ .
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li + 、SO 4 2- ,另含有Al 3+ 、Fe 3+ 、Fe 2+ 、Mg 2+ 、Ca 2+ 、Na + 等杂质,需在搅拌下加入 ____ (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液.
(3)步骤2中,将适量的H 2 O 2 溶液、石灰乳和Na 2 CO 3 溶液依次加入浸出液中,可除去的杂质金属离子有
Fe 2+ 、Mg 2+ 、Ca 2+
Fe 2+ 、Mg 2+ 、Ca 2+
(4)步骤3中,生成沉淀的离子方程为
2Li + +CO 3 2- =Li 2 CO 3 ↓
2Li + +CO 3 2- =Li 2 CO 3 ↓
(5)从母液中可回收的主要物质是
Na 2 SO 4
Na 2 SO 4
.▼优质解答
答案和解析
分析: (1)从反应速率的角度来分析;
(2)抓住题目中的“酸性溶液”,“调节溶液的pH到6.0~6.5”,从所给试剂中选择符合条件的药品;
(3)H 2 O 2 是强氧化剂,可把Fe 2+ 氧化成Fe 3+ ,石灰乳和碳酸钠都是沉淀剂,使溶液中的Fe 2+ 、Mg 2+ 、Ca 2+ ;
(4) 分析Li 2 SO 4 、LiOH和Li 2 CO 3 在303K下的溶解度分别为34.2g、12.7g和1.3g可知,Li 2 CO 3 最易沉淀;
(5)由元素守恒可知,母液中存在较多的Na + 、SO 4 2- .
(2)抓住题目中的“酸性溶液”,“调节溶液的pH到6.0~6.5”,从所给试剂中选择符合条件的药品;
(3)H 2 O 2 是强氧化剂,可把Fe 2+ 氧化成Fe 3+ ,石灰乳和碳酸钠都是沉淀剂,使溶液中的Fe 2+ 、Mg 2+ 、Ca 2+ ;
(4) 分析Li 2 SO 4 、LiOH和Li 2 CO 3 在303K下的溶解度分别为34.2g、12.7g和1.3g可知,Li 2 CO 3 最易沉淀;
(5)由元素守恒可知,母液中存在较多的Na + 、SO 4 2- .
(1)固体颗粒越小,化学反应速率越快,同时可使锂元素尽可能多地溶解到酸中,故答案为:(1)增大固液接触面积,加快浸出反应速率,提高浸出率;
(2)所给三种物质中,只有CaCO 3 能够降低溶液的酸度,提高溶液的pH到6.0~6.5,可除去Fe 3+ 、Al 3+ .,故答案为:石灰石;
(3)步骤Ⅱ中加入H 2 O 2 溶液,可将Fe 2+ 氧化为Fe 3+ ,然后加入石灰乳可除去其中的Fe 3+ 和Mg 2+ ,再加入Na 2 CO 3 溶液可除去Ca 2+ .此时溶液中的离子主要有Li + 、Na + 、SO 4 2- ,
故答案为:Fe 2+ 、Mg 2+ 、Ca 2+ ;
(4)步骤Ⅲ加入饱和Na 2 CO 3 溶液后,主要使Li + 转化为Li 2 CO 3 沉淀,故答案为:2Li + +CO 3 2- =Li 2 CO 3 ↓;
(5)反应后,溶液中的Na 2 SO 4 以及加入的过量Na 2 CO 3 便留在母液中,可回收的主要物质为Na 2 SO 4 ,故答案为:Na 2 SO 4 .
(2)所给三种物质中,只有CaCO 3 能够降低溶液的酸度,提高溶液的pH到6.0~6.5,可除去Fe 3+ 、Al 3+ .,故答案为:石灰石;
(3)步骤Ⅱ中加入H 2 O 2 溶液,可将Fe 2+ 氧化为Fe 3+ ,然后加入石灰乳可除去其中的Fe 3+ 和Mg 2+ ,再加入Na 2 CO 3 溶液可除去Ca 2+ .此时溶液中的离子主要有Li + 、Na + 、SO 4 2- ,
故答案为:Fe 2+ 、Mg 2+ 、Ca 2+ ;
(4)步骤Ⅲ加入饱和Na 2 CO 3 溶液后,主要使Li + 转化为Li 2 CO 3 沉淀,故答案为:2Li + +CO 3 2- =Li 2 CO 3 ↓;
(5)反应后,溶液中的Na 2 SO 4 以及加入的过量Na 2 CO 3 便留在母液中,可回收的主要物质为Na 2 SO 4 ,故答案为:Na 2 SO 4 .
点评: 钠、铝、铁、铜及其化合物是日常生活中非常重要的物质,特别是铝、铁在国民经济中占有极其重要的地位.命题的重点将是钠及其化合物(特别是Na 2 O 2 、Na 2 CO 3 、NaHCO 3 )的性质、铝及其化合物的两性、Fe 2+ 与Fe 3+ 之间的转化关系、铜的冶炼及Cu(OH) 2 的性质等.估计以后高考试题将会在选择题中以离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等角度考查金属元素及其化合物的性质,也会在非选择题中以金属元素的性质为载体,通过推断题、实验题,考查考生运用金属元素的有关知识分析解决问题的能力.以实验探究的形式考查元素化合物的性质将成为以后高考命题的新亮点.
看了(2010?广东)碳酸锂广泛应...的网友还看了以下:
1-18号元素中如果元素气态氢化物为HnR其最高价氧化水化物分子中含m个氧原子则其最高价氧化物水化物 2020-03-30 …
在1~18号元素中,如某元素气态氢化物为HnR,其最高价氧化物水化物分子中含m个氧原子···在1~1 2020-03-30 …
某元素R形成的氢化物为H2R,已知R在最高价氧化物中的质量分数为40%,则R的相对原子某元素R形成 2020-04-27 …
碳和硅的性质相似。碳的最简单的氢化物为甲烷,硅的最简单的氢化物为甲硅烷(SiH4)。甲硅烷是一种无 2020-05-13 …
能说明氧元素的非金属性较硫元素强的事实是A.在通常情况下,氧气是无色气体而硫的单质是黄色固体B.氧 2020-05-17 …
aXn-和bYm+两种简单离子,其电子层结构相同,下列关系式或化学式正确()A.a-n=b+mB. 2020-05-21 …
aXn-和bYm+两种简单离子,其电子层结构相同,下列关系式或化学式正确()A.a-n=b+mB. 2020-05-21 …
某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,则气态氢化物的化学式为;与B元素同一 2020-06-14 …
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中W的气态氢化物摩尔质量为34g/mo 2020-07-29 …
碳和硅的性质相似。碳的最简单的氢化物为甲烷,硅的最简单的氢化物为甲硅烷(SiH4)。甲硅烷是一种无色 2021-01-14 …