早教吧作业答案频道 -->化学-->
工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外.还含有少量NH4+、Fe3+、AsO43-、Cl-.为除去杂质离子,部分操作流程如下:请回答问题:(1)NH4+在用稀硫酸浸泡某矿石后的溶液
题目详情
工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外.还含有少量NH4+、Fe3+、AsO43-、Cl-.为除去杂质离子,部分操作流程如下:
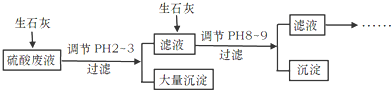
请回答问题:
(1)NH4+在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH4+)恰好是NH4Cl溶液中c(NH4+)的2倍,则c[(NH4)2SO4]___c(NH4Cl)(填:<、=或>).
(2)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中
___(填“增大”、“减小”或“不变”).
(3)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4•2H2O[含有少量Fe(OH)3],提纯CaSO4•2H2O的主要步骤:向沉淀中加入过量___,充分反应后,过滤、洗涤、___.
(4)25℃,H3AsO4电离常数为K1=5.6×10-3、K2=1.7×10-7、K3=4.0×10-12.当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2.
①pH调节到8左右Ca3(AsO4)2 才开始沉淀的原因是___.
②Na3AsO4 第一步水解的平衡常数数值为:___.
③已知:AsO43-+2I-+2H+=AsO43-+I2+H2O,SO2+I2+2H2O=SO42-+2I-+4H+.上述两个反应中还原性最强的微粒是___.

请回答问题:
(1)NH4+在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH4+)恰好是NH4Cl溶液中c(NH4+)的2倍,则c[(NH4)2SO4]___c(NH4Cl)(填:<、=或>).
(2)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中
| [NH3•H2O] |
| [OH-] |
(3)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4•2H2O[含有少量Fe(OH)3],提纯CaSO4•2H2O的主要步骤:向沉淀中加入过量___,充分反应后,过滤、洗涤、___.
(4)25℃,H3AsO4电离常数为K1=5.6×10-3、K2=1.7×10-7、K3=4.0×10-12.当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2.
①pH调节到8左右Ca3(AsO4)2 才开始沉淀的原因是___.
②Na3AsO4 第一步水解的平衡常数数值为:___.
③已知:AsO43-+2I-+2H+=AsO43-+I2+H2O,SO2+I2+2H2O=SO42-+2I-+4H+.上述两个反应中还原性最强的微粒是___.
▼优质解答
答案和解析
硫酸废液中含有大量硫酸外,还含有少量NH4+、Fe3+、AsO43-、Cl-,加入生石灰,调节pH2~3,大量沉淀主要成分为CaSO4•2H2O[含有少量Fe(OH)3],滤液加入生石灰调节pH8~9,生成Ca3(AsO4)2沉淀,滤液主要含有(NH4)2SO4和NH4Cl,
(1)如c[(NH4)2SO4]=c(NH4Cl),则(NH4)2SO4溶液中c(NH4+)较大,因c(NH4+)越大,NH4+水解程度越小,则(NH4)2SO4溶液中c(NH4+)小于是NH4Cl溶液中c(NH4+)的2倍,如等于2倍,则c(NH4Cl)应较大,
故答案为:<;
(2)随着向废液中投入生石灰,c(OH-)增大,c(NH3•H2O)减小,则溶液中
减小,故答案为:减小;
(3)提纯CaSO4•2H2O,可加入稀硫酸溶解Fe(OH)3,且防止CaSO4•2H2O的溶解,过滤后洗涤、干燥,
故答案为:稀硫酸;晾干或干燥;
(4)①H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀,
故答案为:H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2开始沉淀;
②Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O⇌HAsO42-+OH-,该步水解的平衡常数Kh=
=
=
=
=2.5×10-3,
故答案为:2.5×10-3;
③已知:AsO43-+2I-+2H+=AsO33-+I2+H2O,SO2+I2+2H2O=SO42-+2I-+4H+.还原剂还原性大于还原产物的还原性,则还原性SO2>I->AsO33-,两个反应中还原性最强的微粒是SO2,
故答案为:SO2.
(1)如c[(NH4)2SO4]=c(NH4Cl),则(NH4)2SO4溶液中c(NH4+)较大,因c(NH4+)越大,NH4+水解程度越小,则(NH4)2SO4溶液中c(NH4+)小于是NH4Cl溶液中c(NH4+)的2倍,如等于2倍,则c(NH4Cl)应较大,
故答案为:<;
(2)随着向废液中投入生石灰,c(OH-)增大,c(NH3•H2O)减小,则溶液中
| [NH3•H2O] |
| [OH-] |
(3)提纯CaSO4•2H2O,可加入稀硫酸溶解Fe(OH)3,且防止CaSO4•2H2O的溶解,过滤后洗涤、干燥,
故答案为:稀硫酸;晾干或干燥;
(4)①H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀,
故答案为:H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2开始沉淀;
②Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O⇌HAsO42-+OH-,该步水解的平衡常数Kh=
| c(HAsO42-)•c(OH -) |
| c(AsO4 3-) |
| c(HAsO 42-)•c(OH -)•c(H +) |
| c(AsO 43-)•c(H +) |
| Kw |
| K 3 |
| 10 -14 |
| 4.0×10 -12 |
故答案为:2.5×10-3;
③已知:AsO43-+2I-+2H+=AsO33-+I2+H2O,SO2+I2+2H2O=SO42-+2I-+4H+.还原剂还原性大于还原产物的还原性,则还原性SO2>I->AsO33-,两个反应中还原性最强的微粒是SO2,
故答案为:SO2.
看了工厂中用稀硫酸浸泡某矿石后的溶...的网友还看了以下:
用12g石灰石和稀盐酸反应(杂质不反应).生成4.4g二氧化碳,求石灰石的杂质的质 2020-03-30 …
可能用到的相对分子质量:Zn-65H-1O-16Cu-64Ca-40C-12Fe-56S-321. 2020-04-13 …
用12g石灰石和稀盐酸反应(杂质不反应),生成4.4g二氧化碳,求石灰石中杂质的质量 2020-04-26 …
12g石灰石和稀盐酸反映(杂志不反映).生成4.4g二氧化碳,求石灰石的杂质的质量 2020-04-26 …
除去下列物质中所含杂质,所选试剂不正确的是括号内为杂志质A.铜粉(铁粉)试剂:稀硫酸B.熟石灰(生 2020-06-03 …
某课外活动小组为了测定一批石灰石种碳酸钙的质量分数,将石灰石样品研成粉末,然后取一定量的石灰石粉末 2020-06-19 …
将150毫升稀盐酸(密度为1.1克每立方厘米)加入到盛有53克含少量杂质的石灰石的烧杯中,恰好完全 2020-06-19 …
某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取一定量稀盐酸,分别进行四组实 2021-01-20 …
石灰石是主要修路材料之一,某兴趣小组用修路材料石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二 2021-02-06 …
实验室需要0.5molCO2现用含caco390%的石灰石与足量的稀盐酸反应(石灰石中杂质不与稀盐酸 2021-02-06 …