早教吧作业答案频道 -->化学-->
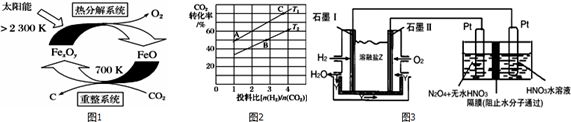
二氧化碳的捕集、利用是我国能源领域的一个重要战略方向.(1)科学家提出由CO2制取C的太阳能工艺如图1所示.①若“重整系统”发生的反应中n(FeO)n(CO2)=6,则FexOy的化
题目详情
二氧化碳的捕集、利用是我国能源领域的一个重要战略方向.
(1)科学家提出由CO2制取C的太阳能工艺如图1所示.
①若“重整系统”发生的反应中
=6,则FexOy的化学式为___.
②“热分解系统”中每分解1molFexOy,转移电子的物质的量为___.
(2)工业上用CO2和H2反应合成甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1
CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJ•mol-1
则2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H3=___kJ•mol-1.
(3)①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是___(填字母).
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的
值变小
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图2所示.T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内
的平均反应速率v(CH3OCH3)=___;KA、KB、KC三者之间的大小关系为___.
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(NH
)___c(HCO
)(填“>”、“<”或“=”);反应NH
+HCO
+H2O⇌NH3•H2O+H2CO3的平衡常数K=___.(已知常温下NH3•H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
(5)现以H2与O2、熔融盐Na2CO3组成的燃料电池(如图3所示,其中Y为CO2)装置进行电解.
写出石墨I电极上发生反应的电极反应式:___.
在电解池中生成N2O5的电极反应式为:___.
(1)科学家提出由CO2制取C的太阳能工艺如图1所示.
①若“重整系统”发生的反应中
| n(FeO) |
| n(CO2) |
②“热分解系统”中每分解1molFexOy,转移电子的物质的量为___.
(2)工业上用CO2和H2反应合成甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1
CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJ•mol-1
则2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H3=___kJ•mol-1.
(3)①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是___(填字母).
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的
| n(CO2) |
| n(H2) |
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图2所示.T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内
的平均反应速率v(CH3OCH3)=___;KA、KB、KC三者之间的大小关系为___.

(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(NH
| + 4 |
| - 3 |
| + 4 |
| - 3 |
(5)现以H2与O2、熔融盐Na2CO3组成的燃料电池(如图3所示,其中Y为CO2)装置进行电解.
写出石墨I电极上发生反应的电极反应式:___.
在电解池中生成N2O5的电极反应式为:___.
▼优质解答
答案和解析
(1)①由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中
=6,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4,
故答案为:Fe3O4;
②热分解系统中是Fe3O4分解为FeO与氧气,分解l mol Fe3O4转移电子的物质的量为1mol×3×(
-2)=2mol,
故答案为:2mol;
(2)已知:①.CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1
②.CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJ•mol-1
根据盖斯定律,①×2-②可得:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g),△H3=2△H1-△H2=2×(-53.7kJ•mol-1)-23.4kJ•mol-1=-130.8kJ•mol-1,
故答案为:-130.8;
(3)①a.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,故a错误;
b.H2的转化率增大,平衡一定正向移动,故b正确;
c.反应物的体积百分含量减小,可能是增大生成物浓度,平衡逆向移动,故c错误;
d.容器中的
变小,可能是减小二氧化碳物质的量,平衡逆向移动,故d错误,
故答案为:b;
②T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH30为6mol×60%×
=1.8mol,所以平均反应速率v(CH3OCH3)=
=0.18mol•L-1•min-1 ;
平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下正向进行程度故T2温度大,则KA=KC>KB,
故答案为:0.18 mol/(L•min);KA=KC>KB;
(4)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,所以碳酸氢根的水解程度更大,所以NH4HCO3显碱性;在NH4HCO3溶液中,c(NH
)>c(HCO
),反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=
=
=
=1.25×10-3;
故答案为:>; 1.25×10-3;
(5)燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2+CO32--2e-=CO2+H2O;
N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:H2-2e-+CO32-═CO2+H2O;N2O4+2HNO3-2e-=2N2O5+2H+.
| n(FeO) |
| n(CO2) |
故答案为:Fe3O4;
②热分解系统中是Fe3O4分解为FeO与氧气,分解l mol Fe3O4转移电子的物质的量为1mol×3×(
| 8 |
| 3 |
故答案为:2mol;
(2)已知:①.CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1
②.CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJ•mol-1
根据盖斯定律,①×2-②可得:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g),△H3=2△H1-△H2=2×(-53.7kJ•mol-1)-23.4kJ•mol-1=-130.8kJ•mol-1,
故答案为:-130.8;
(3)①a.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,故a错误;
b.H2的转化率增大,平衡一定正向移动,故b正确;
c.反应物的体积百分含量减小,可能是增大生成物浓度,平衡逆向移动,故c错误;
d.容器中的
| n(CO2) |
| n(H2) |
故答案为:b;
②T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH30为6mol×60%×
| 1 |
| 2 |
| ||
| 5min |
平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下正向进行程度故T2温度大,则KA=KC>KB,
故答案为:0.18 mol/(L•min);KA=KC>KB;
(4)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,所以碳酸氢根的水解程度更大,所以NH4HCO3显碱性;在NH4HCO3溶液中,c(NH
+ 4 |
- 3 |
| c(NH3•H2O)c(H2CO3) |
| c(NH4+)c(HCO3-) |
| c(H+)c(OH-) |
| K(NH3•H2O)K1 |
| 10-14 |
| 2×10-5×4×10-7 |
故答案为:>; 1.25×10-3;
(5)燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2+CO32--2e-=CO2+H2O;
N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:H2-2e-+CO32-═CO2+H2O;N2O4+2HNO3-2e-=2N2O5+2H+.
看了二氧化碳的捕集、利用是我国能源...的网友还看了以下:
下列集合A到集合B的对应关系中,不能确定y是x的函数的是①A={x|x∈Z}B={y|y∈Z}对应关 2020-03-30 …
我是高一新生,下列集合A到集合B的对应关系中,不能确定y是x的函数的是:①A={x|x∈Z}B={y 2020-03-30 …
下列集合A到集合B的对应关系中,不能确定y是x的函数的是1)A={X|X∈Z}B={y|y∈Z},对 2020-03-30 …
在水溶液中YO3n-和S2-可发生反应:YO3n-+3S2-+6H+═Y-+3S↓+3H2O.下列 2020-05-13 …
最简二次根式2分之一倍的2x-y倍的根号xy与2分之一倍的y+6倍的根号3x+y+2能否是被开方数 2020-05-14 …
大一高数导数问题d(-y''/y'^3)/dx如何求导 我求出来后分子带负号的 项 .总比答案多一 2020-05-17 …
(17)Armstrong 公理系统中的增广律的含义是:设 R 是一个关系模式,X,Y 是U 中属性 2020-05-23 …
新高一数学下列表格中的x与y能够成函数的是A(x是非负数,y是1);(x是非正数,y是-1)B(x 2020-06-10 …
如图中a,b,c表示生物体内的三个生理过程,其中的Y分别代表三种物质,有关Y的叙述,错误的是()A 2020-06-13 …
单质X能从盐溶液中转换出单质Y,由此可知()A.当X、Y都是金属时,X不一定比Y活泼B.当X、Y都 2020-06-17 …