早教吧作业答案频道 -->化学-->
磷酸铁(FePO4•2H2O)是合成磷酸铁锂的前驱体.以绿矾(FeSO4•7H2O)为原料合成磷酸铁的流程如图所示.回答下列问题:(1)在溶解与酸化反应器中需控制n(FeSO4•7H2O)n(H3PO4)
题目详情
磷酸铁(FePO4•2H2O)是合成磷酸铁锂的前驱体.以绿矾(FeSO4•7H2O)为原料合成磷酸铁的流程如图所示.
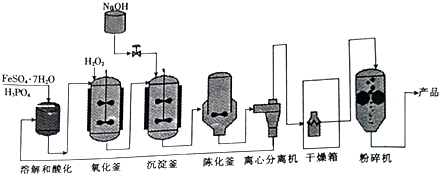
回答下列问题:
(1)在溶解与酸化反应器中需控制
为1:3.5,其目的是:
①保证其pH=1.8;
②___
(2)氧化釜中Fe2+被氧化的离子方程式为___.
(3)在沉淀釜中加碱需控制溶液的pH≤2.2.
①pH偏大时,产品的质量较差,其原因为___(已知Ksp(FePO4)=1.3×10-22,Ksp[Fe(OH)3]=2.8×10-39)
②生成FePO4•2H2O沉淀的离子方程式为___
(4)陈化釜中陈化的目的是___.
(5)合成磷酸亚铁锂(LiFePO4)的步骤如下:
球磨罐中加入适量蒸馏水,再加入一定量的氢氧化锂和一定量的蔗糖使其溶解,用醋酸调节pH到9.0,最后加入一定量的FePO4•2H2O,球磨7h,再经干燥,在700℃和氮气的氛围下煅烧,最后得磷酸亚铁锂.已知:首先发生反应C12H22O11→12C+11H2O.
①球磨的目的是___.
②需在氮气氛围下进行反应的原因是___.
③写出FePO4生成LiFePO4的化学方程式:___.
(6)若测得(5)得到的产品中n(Li):n(Fe):n(P)=0.8:1:1,则产品中
=___.

回答下列问题:
(1)在溶解与酸化反应器中需控制
| n(FeSO4•7H2O) |
| n(H3PO4) |
①保证其pH=1.8;
②___
(2)氧化釜中Fe2+被氧化的离子方程式为___.
(3)在沉淀釜中加碱需控制溶液的pH≤2.2.
①pH偏大时,产品的质量较差,其原因为___(已知Ksp(FePO4)=1.3×10-22,Ksp[Fe(OH)3]=2.8×10-39)
②生成FePO4•2H2O沉淀的离子方程式为___
(4)陈化釜中陈化的目的是___.
(5)合成磷酸亚铁锂(LiFePO4)的步骤如下:
球磨罐中加入适量蒸馏水,再加入一定量的氢氧化锂和一定量的蔗糖使其溶解,用醋酸调节pH到9.0,最后加入一定量的FePO4•2H2O,球磨7h,再经干燥,在700℃和氮气的氛围下煅烧,最后得磷酸亚铁锂.已知:首先发生反应C12H22O11→12C+11H2O.
①球磨的目的是___.
②需在氮气氛围下进行反应的原因是___.
③写出FePO4生成LiFePO4的化学方程式:___.
(6)若测得(5)得到的产品中n(Li):n(Fe):n(P)=0.8:1:1,则产品中
| n(Fe2+) |
| n(Fe3+) |
▼优质解答
答案和解析
绿矾用磷酸溶解和酸化,用过氧化氢将Fe2+氧化为Fe3+,进入氢氧化钠调节pH,析出FePO4•2H2O沉淀,再经过离心分离机分离,磷酸循环利用,经过干燥粉碎得到产品,陈化釜中也是得到FePO4•2H2O,陈化过程是进行提纯.
(1)在溶解与酸化反应器中需控制
为1:3.5,其目的是:①保证其pH=1.8;②PO43-过量有利于析出FePO4,避免Fe3+以其它形式沉淀,提高FePO4的纯度,
故答案为:PO43-过量有利于析出FePO4,避免Fe3+以其它形式沉淀,提高FePO4的纯度;
(2)酸性条件下过氧化氢将Fe2+氧化为Fe3+,同时生成水,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)①pH过大时主要生成氢氧化铁沉淀,产品的质量较差,
故答案为:pH过大时主要生成氢氧化铁沉淀;
②加入氢氧化钠与磷酸反应生成磷酸钠与水,磷酸根与铁离子、水反应生成FePO4•2H2O沉淀,整个过程反应方程式为:Fe3++H3OP4+2OH-=FePO4•2H2O↓+H2O,
故答案为:Fe3++H3OP4+2OH-=FePO4•2H2O↓+H2O;
(4)陈化釜中陈化的目的是:使小晶粒逐渐溶解,大晶粒逐渐长大,提高沉淀的纯度,
故答案为:使小晶粒逐渐溶解,大晶粒逐渐长大,提高沉淀的纯度;
(5)①球磨的目的是:减小FePO4•2H2O颗粒大小,有利于反应物混合均匀,
故答案为:减小FePO4•2H2O颗粒大小,有利于反应物混合均匀;
②需在氮气氛围下进行反应的原因是:隔绝空气,防止二价铁被氧化,
故答案为:隔绝空气,防止二价铁被氧化;
③由题目信息,可知FePO4与LiOH、C反应生成LiFePO4、CO与水,反应方程式为:2FePO4+2LiOH+C
2LiFePO4+CO↑+2H2O,
故答案为:2FePO4+2LiOH+C
2LiFePO4+CO↑+2H2O;
(6)产品中n(Li):n(Fe):n(P)=0.8:1:1,
根据化合价代数和为0,可知0.8×1+2n(Fe2+)+3n(Fe3+)=1×3,
而n(Fe2+)+n(Fe3+)=1,
联立解得n(Fe2+)=0.8,n(Fe3+)=0.2,
故n(Fe2+):n(Fe3+)=0.8:0.2=4:1,
故答案为:4:1.
(1)在溶解与酸化反应器中需控制
| n(FeSO4•7H2O) |
| n(H3PO4) |
故答案为:PO43-过量有利于析出FePO4,避免Fe3+以其它形式沉淀,提高FePO4的纯度;
(2)酸性条件下过氧化氢将Fe2+氧化为Fe3+,同时生成水,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)①pH过大时主要生成氢氧化铁沉淀,产品的质量较差,
故答案为:pH过大时主要生成氢氧化铁沉淀;
②加入氢氧化钠与磷酸反应生成磷酸钠与水,磷酸根与铁离子、水反应生成FePO4•2H2O沉淀,整个过程反应方程式为:Fe3++H3OP4+2OH-=FePO4•2H2O↓+H2O,
故答案为:Fe3++H3OP4+2OH-=FePO4•2H2O↓+H2O;
(4)陈化釜中陈化的目的是:使小晶粒逐渐溶解,大晶粒逐渐长大,提高沉淀的纯度,
故答案为:使小晶粒逐渐溶解,大晶粒逐渐长大,提高沉淀的纯度;
(5)①球磨的目的是:减小FePO4•2H2O颗粒大小,有利于反应物混合均匀,
故答案为:减小FePO4•2H2O颗粒大小,有利于反应物混合均匀;
②需在氮气氛围下进行反应的原因是:隔绝空气,防止二价铁被氧化,
故答案为:隔绝空气,防止二价铁被氧化;
③由题目信息,可知FePO4与LiOH、C反应生成LiFePO4、CO与水,反应方程式为:2FePO4+2LiOH+C
| ||
| 700℃ |
故答案为:2FePO4+2LiOH+C
| ||
| 700℃ |
(6)产品中n(Li):n(Fe):n(P)=0.8:1:1,
根据化合价代数和为0,可知0.8×1+2n(Fe2+)+3n(Fe3+)=1×3,
而n(Fe2+)+n(Fe3+)=1,
联立解得n(Fe2+)=0.8,n(Fe3+)=0.2,
故n(Fe2+):n(Fe3+)=0.8:0.2=4:1,
故答案为:4:1.
看了磷酸铁(FePO4•2H2O)...的网友还看了以下:
几个数学题x:3=4:y,x和y成什么比例?正比例还是反比例?如果3x=4y,那么x和y成什么比里 2020-05-13 …
同一溶液中氧化还原反应和非氧化还原反应哪个先发生反应,为什么?另外氢氧化钠和明矾反应时氢氧根是先和 2020-05-14 …
已知函数y=y1+y2,且y1与x成正比例,y2与x-2成反比例,并且当x=-2时,y=-7,当x 2020-06-06 …
运用修辞手法的题目,如比喻是花的海洋,还有其他,拟人,互文什么的,越多越好,要原创不要诗句,2.1 2020-06-13 …
如果3m-2与-7互为相反数,那么m的相反数是多少.(1)如果3m-2与-7互为相反数,那么m的相 2020-06-29 …
用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3)制取绿矾(FeSO4•7H2 2020-07-06 …
余弦函数的反函数cosx=1/7,x属于[-pi/2,pi/2].求它的反函数.并给出解题理由.练 2020-07-08 …
2列反应中不正确的是()A.用惰性电极电解AlCl3溶液:2Cl-+2H2O电解.H2↑+Cl2↑ 2020-07-16 …
铝土矿的主要成分为Al2O3.生产铵明矾[NH4Al(SO4)2•12H2O]和H2O2的工艺流程图 2020-11-02 …
(1)明矾晶体可用来净水,它的化学式为.(2)反应KClO3+6HCl=KCl+3Cl2↑+3H2O 2021-02-09 …