早教吧作业答案频道 -->化学-->
草酸铜(CuC2O4•2H2O)是制备纳米CuO的前驱体,可利用草酸和印刷线路板的酸性蚀刻废液为原料制取.(1)7.6gCuC2O4在350℃灼烧完全分解生成CuO和气体,产生气体的体积为L(标准状况).
题目详情
草酸铜(CuC2O4•2H2O)是制备纳米CuO的前驱体,可利用草酸和印刷线路板的酸性蚀刻废液为原料制取.
(1)7.6gCuC2O4在350℃灼烧完全分解生成CuO和气体,产生气体的
体积为___L(标准状况).
(2)已知pKa=-lgKa,25℃时,H2C2O4的pKa1=1.2,pKa2=4.19,
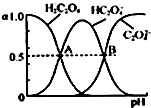
草酸溶液中含碳各物种的分布分数α(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如右图所示.A点溶液的PH为___;0.1mol•L-1NaHC2O4与0.1mol•L-1Na2 C2O4溶液等体积混合,所得溶液中微粒浓度从大到小的顺序为___(填序号).
①c(H+)②c(HC2O4-)③c (H2C2O4)④c (C2O42-)
(3)某合作学习小组的同学按下列步骤检测原料中酸性蚀刻废液中铜的含量:
Ⅰ.取100.00mL澄清的“酸性蚀刻废液”,加H2O2,然后调节pH约为3,过滤除去Fe(OH)3.
Ⅱ.取Ⅰ的滤液加入NH4HF2排除微量的Fe3+干扰,然后将溶液稀释定容到250mL容量瓶中,得溶液A.
Ⅲ.取25.00mL溶液A于锥形瓶中,加入稍过量的KI溶液(2Cu2++5I-=2Cul↓+I3),用0.1000mol/LNa2S2O3溶液滴定(2S2O32-+I3-=S4O62-+3I-)到近终点时,加入淀粉继续滴定,再加入KSCN溶液[Cul(s)+SCN-(aq)⇌CuSCN(s)+I-(aq)],振荡后继续滴定至极点,共消耗Na2S2O3标准溶液20.00mL.
①若缺少步骤Ⅰ、Ⅱ会导致测定的铜的含量___(填“偏大”“偏小”或“不变”).
②已知Cul能吸附I2不能被滴定,CuSCN不吸附碘,向Cul悬浊液中加入KSCN溶液,达到平衡后溶液中c(SCN-)=___[用c(I-)、Ksp(Cul)和Ksp(CuSCN)].
③计算原“酸性蚀刻废液”中铜离子浓度(用每升蚀刻废液中含铜的质量表示,单位g•L-1)(请给出计算过程).

(1)7.6gCuC2O4在350℃灼烧完全分解生成CuO和气体,产生气体的
体积为___L(标准状况).
(2)已知pKa=-lgKa,25℃时,H2C2O4的pKa1=1.2,pKa2=4.19,
草酸溶液中含碳各物种的分布分数α(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如右图所示.A点溶液的PH为___;0.1mol•L-1NaHC2O4与0.1mol•L-1Na2 C2O4溶液等体积混合,所得溶液中微粒浓度从大到小的顺序为___(填序号).
①c(H+)②c(HC2O4-)③c (H2C2O4)④c (C2O42-)
(3)某合作学习小组的同学按下列步骤检测原料中酸性蚀刻废液中铜的含量:
Ⅰ.取100.00mL澄清的“酸性蚀刻废液”,加H2O2,然后调节pH约为3,过滤除去Fe(OH)3.
Ⅱ.取Ⅰ的滤液加入NH4HF2排除微量的Fe3+干扰,然后将溶液稀释定容到250mL容量瓶中,得溶液A.
Ⅲ.取25.00mL溶液A于锥形瓶中,加入稍过量的KI溶液(2Cu2++5I-=2Cul↓+I3),用0.1000mol/LNa2S2O3溶液滴定(2S2O32-+I3-=S4O62-+3I-)到近终点时,加入淀粉继续滴定,再加入KSCN溶液[Cul(s)+SCN-(aq)⇌CuSCN(s)+I-(aq)],振荡后继续滴定至极点,共消耗Na2S2O3标准溶液20.00mL.
①若缺少步骤Ⅰ、Ⅱ会导致测定的铜的含量___(填“偏大”“偏小”或“不变”).
②已知Cul能吸附I2不能被滴定,CuSCN不吸附碘,向Cul悬浊液中加入KSCN溶液,达到平衡后溶液中c(SCN-)=___[用c(I-)、Ksp(Cul)和Ksp(CuSCN)].
③计算原“酸性蚀刻废液”中铜离子浓度(用每升蚀刻废液中含铜的质量表示,单位g•L-1)(请给出计算过程).
▼优质解答
答案和解析
(1)CuC2O4在350℃灼烧完全分解方程式为CuC2O4
CuO+CO+CO2↑,n(CuC2O4)=
=005mol,则气体的总物质的量为0.1mol,所以其体积为2.24L;
故答案为:2.24;
(2)A点时Ka=
,由图象可知,c(HC2O4-)=c(H2C2O4),则c(H+)=Ka1,所以pH=pKa1=1.2;0.1mol•L-1NaHC2O4与0.1mol•L-1Na2 C2O4溶液等体积混合,HC2O4-的电离程度大于C2O42-的水解程度,溶液显酸性,则c (C2O42-)>c(HC2O4-),由于电离和水解程度均较小,所以c(HC2O4-)>c(H+),所以溶液中离子浓度关系:c (C2O42-)>c(HC2O4-)>c(H+)>c(H2C2O4),即液中微粒浓度从大到小的顺序为④②①③;
故答案为:1.2;④②①③;
(3)①若缺少步骤Ⅰ、Ⅱ,溶液中存在Fe3+,则Fe3+能消耗碘离子,使测定的Cu2+的物质的量偏大,导致测定的铜的含量偏大;
故答案为:偏大;
②混合溶液中
=
,则c(SCN-)=
•c(I-);
故答案为:
•c(I-);
③已知:2Cu2++5I-=2Cul↓+I3,2S2O32-+I3-=S4O62-+3I-,则n(Cu2+)=n(S2O32-)=0.1mol/L×0.02L=0.002mol,所以m(Cu)=0.128g,
则原“酸性蚀刻废液”中铜离子浓度=
=12.8g/L;
答:原“酸性蚀刻废液”中铜离子浓度为12.8g/L.
| ||
| 7.6g |
| 152g/mol |
故答案为:2.24;
(2)A点时Ka=
| c(HC2O4-)×c(H+) |
| c(H2C2O4) |
故答案为:1.2;④②①③;
(3)①若缺少步骤Ⅰ、Ⅱ,溶液中存在Fe3+,则Fe3+能消耗碘离子,使测定的Cu2+的物质的量偏大,导致测定的铜的含量偏大;
故答案为:偏大;
②混合溶液中
| c(SCN-) |
| c(I-) |
| Ks(CuSCN) |
| Ks(CuI) |
| Ksp(CuSCN) |
| Ksp(CuI) |
故答案为:
| Ksp(CuSCN) |
| Ksp(CuI) |
③已知:2Cu2++5I-=2Cul↓+I3,2S2O32-+I3-=S4O62-+3I-,则n(Cu2+)=n(S2O32-)=0.1mol/L×0.02L=0.002mol,所以m(Cu)=0.128g,
则原“酸性蚀刻废液”中铜离子浓度=
0.128g×
| ||
| 0.1L |
答:原“酸性蚀刻废液”中铜离子浓度为12.8g/L.
看了草酸铜(CuC2O4•2H2O...的网友还看了以下:
下列说法不正确的是()A.液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动 2020-05-13 …
下列关于物质特征的一些说法中,不正确的是()A、固体有一定体积和形状B、液体有一定的形状和没有一定 2020-05-13 …
临界状态下的天然气呈现( )。A.气体状态B.液体状态C.固体状态D.流体状态 2020-05-31 …
有一白色固体A,加入油状无色液体B,可得紫黑色固体C,C微溶于水,加入A后C的溶解度增大,成棕色溶 2020-06-13 …
液晶最主要的应用之一就是用在液晶显示器上,关于液晶,下列说法正确的是()A.液晶就是液态的晶体B. 2020-06-27 …
切除垂体的幼年大白鼠不会出现()A.智力低下,尿量改变B.甲状腺重量下降,生长发育缓慢C.血液中促 2020-07-11 …
下列关于体液调节的叙述正确的是()A.激素在人体内的含量很少,但有高效的生物催化作用B.促甲状腺激 2020-07-11 …
下列说法不正确的是()A.液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动 2020-07-24 …
海波的熔点是48摄氏度,将48摄氏度的海波加热,温度立即上升,问加热前的海波处于什么状态?A.液态B 2020-11-28 …
标准状况下,将NO2和O2按4:1体积比充满一烧瓶,烧瓶倒置于水中待液面稳定(假设溶质不向外扩散), 2020-12-20 …