早教吧作业答案频道 -->化学-->
铁及其化合物在日常生活中很常见(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如图1:回答下列问题:①操作II所包含的两项主要基本操作是.上述流程中,Fe(OH)2转化成Fe(OH
题目详情
铁及其化合物在日常生活中很常见
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如图1:
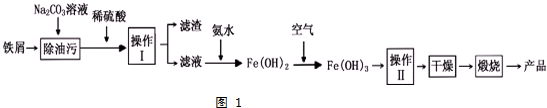
回答下列问题:
①操作II所包含的两项主要基本操作是___. 上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为___.
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,请写出反应的化学方程式:___.
(2)有些同学认为用KMnO4溶液能进行绿矾(FeSO4•7H2O)产品中铁元素含量的测定,反应的离子方程式为:___,该滴定过程中___(填“是”或“否”)还需要指示剂.
实验步骤如下:
a.考虑绿矾产品可能因为保存不当被空气中氧气所氧化,所以事先取少量绿矾产品溶于水,滴加___溶液进行验证.
b.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容
c.量取25.00mL待测溶液于锥形瓶中
d.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL
请完成下列问题:
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需___.
②某同学设计的图2下列滴定方式,最合理的是___.(夹持部分略去)(填字母序号)
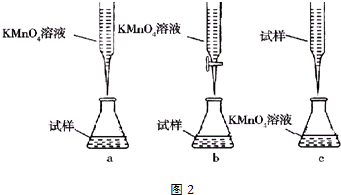
③计算上述样品中FeSO4•7H2O的质量分数为___.
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如图1:

回答下列问题:
①操作II所包含的两项主要基本操作是___. 上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为___.
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,请写出反应的化学方程式:___.
(2)有些同学认为用KMnO4溶液能进行绿矾(FeSO4•7H2O)产品中铁元素含量的测定,反应的离子方程式为:___,该滴定过程中___(填“是”或“否”)还需要指示剂.
实验步骤如下:
a.考虑绿矾产品可能因为保存不当被空气中氧气所氧化,所以事先取少量绿矾产品溶于水,滴加___溶液进行验证.
b.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容
c.量取25.00mL待测溶液于锥形瓶中
d.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL
请完成下列问题:
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需___.
②某同学设计的图2下列滴定方式,最合理的是___.(夹持部分略去)(填字母序号)

③计算上述样品中FeSO4•7H2O的质量分数为___.
▼优质解答
答案和解析
(1)①铁屑用纯碱溶液洗去油污,加稀硫酸充分反应,经过过滤分离,在滤液中加入氨水得到氢氧化亚铁,氢氧化亚铁被氧化为氢氧化铁,再经过过滤、洗涤,然后再干燥,灼烧得到氧化铁,则:操作Ⅱ所包含的两项主要基本操作是:过滤、洗涤,上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:过滤、洗涤;4Fe(OH)2+2H2O+O2=4Fe(OH)3;
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,需要有氧气参与反应,反应还生成HCl,反应方程式为:4FeCl2+4H2O+O2
2Fe2O3+8HCl,
故答案为:4FeCl2+4H2O+O2
2Fe2O3+8HCl;
(2)高锰酸钾溶液具有强氧化性,将Fe2+氧化为Fe3+,自身为还原为Mn2+,反应离子方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色变浅紫红色,不需要另外加入指示剂,
步骤a,Fe2+被氧化为Fe3+,所以事先取少量绿矾产品溶于水,滴加KSN溶液进行验证,若溶液变红色,说明被氧化,否则未被氧化,
①配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250 mL容量瓶;
②酸性高锰酸钾溶液具有强氧化性,盛放在酸式滴定管中,样品硫酸亚铁溶液呈酸性,应用酸式滴定管盛放,且向锥形瓶滴加硫酸亚铁溶液,与空气接触增大,会被氧气氧化,导致误差增大,故b最合理;
③n(MnO4-)=0.01000mol/L×0.02L=2×10-4mol,由5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,可知n(Fe2+)=5×2×10-4mol=1×10-3mol,
所以250mL溶液中含有知n(Fe2+)=1×10-3mol×
=1×10-2mol,
则m(FeSO4•7H2O)=278g/mol×1×10-2mol=2.78g,
样品中FeSO4•7H2O的质量分数为
×100%=97.5%,
故答案为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O;否;a.KSCN;①250mL容量瓶;②b;③97.5%.
故答案为:过滤、洗涤;4Fe(OH)2+2H2O+O2=4Fe(OH)3;
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,需要有氧气参与反应,反应还生成HCl,反应方程式为:4FeCl2+4H2O+O2
| ||
故答案为:4FeCl2+4H2O+O2
| ||
(2)高锰酸钾溶液具有强氧化性,将Fe2+氧化为Fe3+,自身为还原为Mn2+,反应离子方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色变浅紫红色,不需要另外加入指示剂,
步骤a,Fe2+被氧化为Fe3+,所以事先取少量绿矾产品溶于水,滴加KSN溶液进行验证,若溶液变红色,说明被氧化,否则未被氧化,
①配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250 mL容量瓶;
②酸性高锰酸钾溶液具有强氧化性,盛放在酸式滴定管中,样品硫酸亚铁溶液呈酸性,应用酸式滴定管盛放,且向锥形瓶滴加硫酸亚铁溶液,与空气接触增大,会被氧气氧化,导致误差增大,故b最合理;
③n(MnO4-)=0.01000mol/L×0.02L=2×10-4mol,由5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,可知n(Fe2+)=5×2×10-4mol=1×10-3mol,
所以250mL溶液中含有知n(Fe2+)=1×10-3mol×
| 250mL |
| 25mL |
则m(FeSO4•7H2O)=278g/mol×1×10-2mol=2.78g,
样品中FeSO4•7H2O的质量分数为
| 2.78g |
| 2.850g |
故答案为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O;否;a.KSCN;①250mL容量瓶;②b;③97.5%.
看了铁及其化合物在日常生活中很常见...的网友还看了以下:
计算机进制转换(要步骤)二进制数1111111111转换为十进制数为八进制数37.21转换为二进制 2020-05-17 …
(单选)在编制转账凭证时,要求不宜编制一借多贷或多借多贷,这是为了适应()的要求。(单选)在编制转 2020-06-20 …
shorti=i+1;会报错,需要强制转换,那I+=1为什么不需要呢,两个操作符有什么区别么?如题 2020-06-26 …
pascal题目-栈-进制转换题目描述十进制数N和其他d进制数的转换是计算机实现计算的基本问题,其 2020-06-28 …
十进制数:65536转化为十六进制数,直接结算不要先转二进制来算,我算了好多次都是是B0,可是答十 2020-07-09 …
求解十进制转八进制,急今晚要,正确追加50分0.305(305循环)的十进制转八进制0.305(0 2020-07-13 …
利用补码求解十进制数177与193的差十进制转化为二进制177与193的原码反码和补码转换对两个数 2020-07-18 …
求解十进制转八进制,急今晚要,正确追加50分0.305(305循环)的十进制转八进制0.305(0 2020-07-19 …
关于十进制转换二进制的误差问题十进制转换成二进制,误差小于5‰(注意是千分之五).不理解这个误差要 2020-07-22 …
下列经济业务中,需要编制转账凭证的是()。A、收到销售产品的货款B、支付购买材料的货款C、从银行提下 2020-12-26 …