早教吧作业答案频道 -->化学-->
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.(1)
题目详情
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
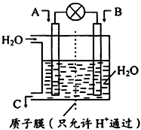
(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:___;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2⇌CH3OH+H2O
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:___;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=___,该反应的△H___0(填“>”或“<”).
②实验3中,若平衡时,CO的转化率大于水蒸气,则
的值___(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V逆___V正(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是___.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都相等
D.容器中气体的平均相对分子质量不随时间而变化.

(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:___;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2⇌CH3OH+H2O
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:___;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则
| b |
| a |
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V逆___V正(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是___.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都相等
D.容器中气体的平均相对分子质量不随时间而变化.
▼优质解答
答案和解析
(1)SO2在负极失去电子转化为SO42-,故其电极反应为:SO2+2H2O-2e-=SO42-+4H+,故答案为:SO2+2H2O-2e-=SO42-+4H+;
(2)应用盖斯定律解题,△H=-△H1-△H2+
△H3+2△H4=-(
c+2d-a-b)kJ•mol-1,所以CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-(
c+2d-a-b)kJ•mol-1,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-(
c+2d-a-b)kJ•mol-1;
(3)①实验1中CO的转化率为×100%=40%,实验2中CO的转化率为×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=
=0.17,
故答案为:0.17;<;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,所以要使CO的转化率大于水蒸气,则
>1,故答案为:
>1;
③900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol时,浓度商Qc=1>0.17=K,所以此时平衡要逆向移动,故V正<V逆,故答案为:>;
④A.CO2减少的化学反应速率和CO减少的化学反应速率相等,证明正逆反应速率相等,达到了平衡,故正确;
B.反应前后气体系数和相等,容器内气体压强始终保持不变,所以压强不变的状态不一定平衡,故错误;
C.CO、H2O、CO2、H2的浓度相等,可能平衡也可能不平衡,故错误;
D.容器中气体的平均相对分子质量等于质量和物质的量的比值,质量和物质的量都不变化,所以容器中气体的平均相对分子质量始终不随时间而变化,此时的状态不一定是平衡状态,故错误.
故选A.
(2)应用盖斯定律解题,△H=-△H1-△H2+
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
(3)①实验1中CO的转化率为×100%=40%,实验2中CO的转化率为×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=
| 0.4×0.4 |
| 1.6×0.6 |
故答案为:0.17;<;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,所以要使CO的转化率大于水蒸气,则
| b |
| a |
| b |
| a |
③900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol时,浓度商Qc=1>0.17=K,所以此时平衡要逆向移动,故V正<V逆,故答案为:>;
④A.CO2减少的化学反应速率和CO减少的化学反应速率相等,证明正逆反应速率相等,达到了平衡,故正确;
B.反应前后气体系数和相等,容器内气体压强始终保持不变,所以压强不变的状态不一定平衡,故错误;
C.CO、H2O、CO2、H2的浓度相等,可能平衡也可能不平衡,故错误;
D.容器中气体的平均相对分子质量等于质量和物质的量的比值,质量和物质的量都不变化,所以容器中气体的平均相对分子质量始终不随时间而变化,此时的状态不一定是平衡状态,故错误.
故选A.
看了燃煤能排放大量的CO、CO2、...的网友还看了以下:
“温室效应”是全球关注的环境问题“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的 2020-05-13 …
金融机构在识别境外单位客户时有效身份证件包括()A.经过公证的境外有效商业注册登记证明文件B 2020-05-26 …
境内个人超过年度总额的境外投资收益结汇,除了应向银行提供有效身份证件外,还应提供():A.境外 2020-05-27 …
今年春季,由于缺乏市场指导,盲目种植及气候等因素影响,大量应季的南北蔬菜集中上市,致使某些蔬菜的收 2020-06-27 …
化学在人类生活中扮演着重要角色,下列说法正确的是()A.氯处理饮用水时,在夏季的杀菌效果比在冬季好 2020-06-30 …
关于环境描写的句子就一年四季的环境描写的句子世间万物的环境描写的句子还有描写有钱人家的别墅的那种富 2020-07-28 …
“三网”绿化工程是市委、市政府为全面改善我市生态环境,促进黄河三角洲开发建设实施的重点战略决策.大面 2020-11-04 …
阳光小学为美化校园环境进行栽花.在杜鹃140棵,再加上46棵就是所载月季的3倍,栽了栽了多少棵月季? 2020-11-04 …
2012年枣庄市委、市政府提出:创建国家级森林城市,营造绿色家居家园。大量植树造林既能美化环境、绿化 2020-11-04 …
“温室效应”是全球关注的环境问题“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一 2020-11-21 …