早教吧作业答案频道 -->化学-->
B、C、Si是几种常见的重要非金属元素,其形成的各种化合物在自然界中广泛存在.(1)基态硼原子的电子排布式为.C、N、Si元素原子的第一电离能由大到小的顺序为.(2)BF3与一定量
题目详情
B、C、Si是几种常见的重要非金属元素,其形成的各种化合物在自然界中广泛存在.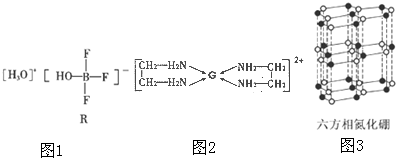
(1)基态硼原子的电子排布式为___.C、N、Si元素原子的第一电离能由大到小的顺序为___.
(2)BF3与一定量的水可形成如图1的晶体R.
①晶体R中各种微粒间的作用力涉及___(填字母).
a、离子键 b、共价键 c、配位键 d、金属键 e、范德华力
②R中阴离子的空间构型为___.
(3)乙二胺(H2N-CH2-CH2-NH2)与CaCl2溶液可形成配离子(结构如图2)乙二胺分子中氮原子的杂化类型为___.乙二胺和三甲胺[N(CH3)3]均属于铵,但乙二胺比三甲胺的沸点高得多,原因是___.
(4)氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.它的晶体结构如图3所示.六方相氮化硼是否含有π键?___(填“含”或“不含”),其质地软的原因是___,该物质能否导电?___(填“能”或“不能”),原因是___.
(5)SiC是原子晶体,其晶胞结构类似金刚石,假设正方体的边长为acm,估算SiC晶体的密度为___g•cm-3(用含NA、a的代数式表示)

(1)基态硼原子的电子排布式为___.C、N、Si元素原子的第一电离能由大到小的顺序为___.
(2)BF3与一定量的水可形成如图1的晶体R.
①晶体R中各种微粒间的作用力涉及___(填字母).
a、离子键 b、共价键 c、配位键 d、金属键 e、范德华力
②R中阴离子的空间构型为___.
(3)乙二胺(H2N-CH2-CH2-NH2)与CaCl2溶液可形成配离子(结构如图2)乙二胺分子中氮原子的杂化类型为___.乙二胺和三甲胺[N(CH3)3]均属于铵,但乙二胺比三甲胺的沸点高得多,原因是___.
(4)氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.它的晶体结构如图3所示.六方相氮化硼是否含有π键?___(填“含”或“不含”),其质地软的原因是___,该物质能否导电?___(填“能”或“不能”),原因是___.
(5)SiC是原子晶体,其晶胞结构类似金刚石,假设正方体的边长为acm,估算SiC晶体的密度为___g•cm-3(用含NA、a的代数式表示)
▼优质解答
答案和解析
(1)硼原子核外有5个电子,其核外电子排布式为:1s22s22p1,同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N、si三种元素的第一电离能由大到小的顺序为:N>C>Si,故答案为:1s22s22p1;N>C>Si;
(2)晶体R中各种微粒间的作用力涉及离子键、共价键、配位键、范德华力;阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式,为四面体构型;故答案为:abce;四面体;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化.
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高.
故答案为:sp3杂化;乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(4)B位于第2周期ⅢA族,核外电子排布式1s22s22p1,形成的六方相氮化硼,每一个B与3个N原子相连,每1个N原子与3个B原子相连,形平面三角形,向空间发展成层状结构.六方相氮化硼,不含π键,只含σ键,层与层之间通过范德华力结合在一起;作用力小,导致其质地软,六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,该物质的层状结构中不存在自由移动的电子,所以不导电;
故答案为:不含;层与层之间通过范德华力结合在一起,作用力小,导致其质地软;不能;层状结构中没有自由移动的电子;
(5)该晶胞中C原子个数=8×
+6×
=4,Si原子个数为4,晶胞边长=acm,体积V=(acm)3,ρ=
=
g•cm3;
故答案为:
.
(2)晶体R中各种微粒间的作用力涉及离子键、共价键、配位键、范德华力;阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式,为四面体构型;故答案为:abce;四面体;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化.
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高.
故答案为:sp3杂化;乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(4)B位于第2周期ⅢA族,核外电子排布式1s22s22p1,形成的六方相氮化硼,每一个B与3个N原子相连,每1个N原子与3个B原子相连,形平面三角形,向空间发展成层状结构.六方相氮化硼,不含π键,只含σ键,层与层之间通过范德华力结合在一起;作用力小,导致其质地软,六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,该物质的层状结构中不存在自由移动的电子,所以不导电;
故答案为:不含;层与层之间通过范德华力结合在一起,作用力小,导致其质地软;不能;层状结构中没有自由移动的电子;
(5)该晶胞中C原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| ρ |
| V |
| 40×4 |
| a3NA |
故答案为:
| 40×4 |
| a3NA |
看了B、C、Si是几种常见的重要非...的网友还看了以下:
勤奋学习的小聪为了方便晚上学习,决定买盏台灯.在商店里他看到了两种灯:一盏是10瓦的节能灯,勤奋学 2020-05-13 …
小明打算把1000元钱存入银行两年,有两种储蓄办法:一种是两年期的定期储蓄,年利率是3.25%,一 2020-06-06 …
南北两边种树,由于道路两边要种的树棵数相等,于是他俩商定,一人负责一边.第二天一大早,富勒就来到道 2020-06-18 …
恒温槽和干体炉是一种东西么?有什么区别?希望有高人能帮我解释一下这两种设备.我知道恒温槽是设定一个 2020-06-30 …
播种前,农民伯伯会用盐水来选种,配制一定浓度的盐水,将种子放到盐水中,干瘪的或颗粒小的种子会浮上水 2020-07-02 …
某人购买了1500元的债券,定期一年,到期兑换后他用去了435元后把其余的钱有购买了这种定期1年的 2020-07-03 …
我发现了一种定理,n²=(n-1)×(n+1)+1.如:5²=4×6+1=25113²=112×1 2020-07-18 …
种子在萌发的过程中,各部分起到一定的作用,请回答:(1)大多数双子叶植物的种子由种皮和构成.(2) 2020-07-28 …
小明打算把1000元存入银行两年,有两种储蓄办法:一种是两年期的定期储蓄,年利率是3.25%,一种是 2020-11-06 …
小明打算把1000元存入银行两年,有两种储蓄办法:一种是两年期的定期储蓄,年利率是3.25%,一种是 2020-11-06 …