早教吧作业答案频道 -->化学-->
中国科技网2013年2月6日报导:中国工程院院士范良士教授领导的研究小组,成功开发出煤清洁燃烧的新方法.该方法的流程如图所示:利用化学循环技术使煤释放热量的同时,捕获了反应过
题目详情
中国科技网2013年2月6日报导:中国工程院院士范良士教授领导的研究小组,成功开发出煤清洁燃烧的新方法.该方法的流程如图所示:
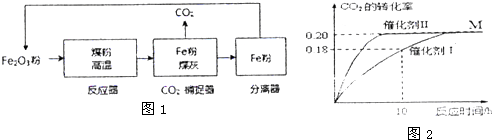
利用化学循环技术使煤释放热量的同时,捕获了反应过程中产生的99%的二氧化碳,高温铁粉用来发电,氧化后循环使用,达到电力和化工的联产,煤炭资源综合利用的目的.
(1)己知下列热化学方程式:
①C(s)+1/2O2(g)=CO(g)△H1=-110.4KJ/mo1
②C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H3=-26.7KJ/mo1
则Fe2O3与C(s)反应生成Fe(s)和CO2(g)的热化学方程式为:___.
(2)捕捉到的CO2可以和H2合成绿色燃料甲醇.300°C时,在两个容积均为2L的密闭容器中,当c(CO2)=1.00mo1•L-1、c(H2)=1.60mol•L-1时,
分别选择催化剂I、催化剂Ⅱ开始反应,达到平衡状态M.反应结果如图所示.
请回答下列问题:
①使用催化剂I时,反应在10h内的平均反应速率:
V(H2)=___mol___•(L•h)-1.达到平衡M时比较两个容器中的正反应速率催化剂I___催化剂II(填“>”或“<”或“=”).
②达到平衡M后,甲醇的体积分数为___(保留到小数点后两位);此反应在300°C时的平衡常数为___.
③若继续向上述平衡体系M中通入0.4molCO2和0.4mol甲醇,平衡将向___移动(填“正向”或“逆向”),达到平衡时得到H2的浓度为amol/L;若继续向上述平衡体系M中通入0.8molCO2和0.4molH2O,达到平衡时得到H2的浓度为bmol/L,则a___b(填“>”或“<”或“=”).

利用化学循环技术使煤释放热量的同时,捕获了反应过程中产生的99%的二氧化碳,高温铁粉用来发电,氧化后循环使用,达到电力和化工的联产,煤炭资源综合利用的目的.
(1)己知下列热化学方程式:
①C(s)+1/2O2(g)=CO(g)△H1=-110.4KJ/mo1
②C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H3=-26.7KJ/mo1
则Fe2O3与C(s)反应生成Fe(s)和CO2(g)的热化学方程式为:___.
(2)捕捉到的CO2可以和H2合成绿色燃料甲醇.300°C时,在两个容积均为2L的密闭容器中,当c(CO2)=1.00mo1•L-1、c(H2)=1.60mol•L-1时,
分别选择催化剂I、催化剂Ⅱ开始反应,达到平衡状态M.反应结果如图所示.
请回答下列问题:
①使用催化剂I时,反应在10h内的平均反应速率:
V(H2)=___mol___•(L•h)-1.达到平衡M时比较两个容器中的正反应速率催化剂I___催化剂II(填“>”或“<”或“=”).
②达到平衡M后,甲醇的体积分数为___(保留到小数点后两位);此反应在300°C时的平衡常数为___.
③若继续向上述平衡体系M中通入0.4molCO2和0.4mol甲醇,平衡将向___移动(填“正向”或“逆向”),达到平衡时得到H2的浓度为amol/L;若继续向上述平衡体系M中通入0.8molCO2和0.4molH2O,达到平衡时得到H2的浓度为bmol/L,则a___b(填“>”或“<”或“=”).
▼优质解答
答案和解析
(1)①C(s)+1/2O2(g)=CO(g)△H1=-110.4KJ/mo1
②C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H3=-26.7KJ/mo1
依据盖斯定律[(①-②×
)×3+③]×2得到,Fe2O3与C(s)反应生成Fe(s)和CO2(g)的热化学方程式为:2Fe2O3+3C(s)=4Fe(s)+3CO2(g)△H=464.7KJ/mol,
故答案为:2Fe2O3+3C(s)=4Fe(s)+3CO2(g)△H=464.7KJ/mol;
(2)①用催化剂I时,反应在10小时内二氧化碳的转化率为0.18,二氧化碳的浓度变化为:1.00mol•L-1×0.18=0.18mol/L,则反应在10小时内二氧化碳的平均反应速率为:v(CO2)=
=0.018mol•(L•h)-1,则v(H2)=3v(CO2)=0.054mol•(L•h)-1,达到平衡M时催化剂I需要的时间长,则两个容器中的正反应速率催化剂I<催化剂Ⅱ,
故答案为:0.054,<;
②反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),结合化学平衡三段式列式,平衡时二氧化碳转化率为20%,反应的二氧化碳物质的量=20%×1mol/L×2=0.4mol,
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
起始量(mol) 2 3.2 0 0
变化量(mol) 0.4 1.2 0.4 0.4
平衡量(mol) 1.6 2 0.4 0.4
甲醇的体积分数=
×100%=9.10%
平衡常数=
=0.05
故答案为:9.10%,0.05;
③若继续向上述平衡体系M中通入0.4molCO2和0.4mol甲醇,此时浓度商=
=0.08>K=0.05,平衡逆向进行,若继续向上述平衡体系M中通入0.8molCO2和0.4molH2O,两种反应物增大一种物质会提高另一种物质的转化率,氢气浓度减小,达到平衡时得到H2的浓度amol/>bmol/L,
故答案为:逆向,>.
②C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H3=-26.7KJ/mo1
依据盖斯定律[(①-②×
| 1 |
| 2 |
故答案为:2Fe2O3+3C(s)=4Fe(s)+3CO2(g)△H=464.7KJ/mol;
(2)①用催化剂I时,反应在10小时内二氧化碳的转化率为0.18,二氧化碳的浓度变化为:1.00mol•L-1×0.18=0.18mol/L,则反应在10小时内二氧化碳的平均反应速率为:v(CO2)=
| 0.18mol/L |
| 10h |
故答案为:0.054,<;
②反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),结合化学平衡三段式列式,平衡时二氧化碳转化率为20%,反应的二氧化碳物质的量=20%×1mol/L×2=0.4mol,
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
起始量(mol) 2 3.2 0 0
变化量(mol) 0.4 1.2 0.4 0.4
平衡量(mol) 1.6 2 0.4 0.4
甲醇的体积分数=
| 0.4mol |
| (1.6+2+0.4+0.4)mol |
平衡常数=
| ||||
|
故答案为:9.10%,0.05;
③若继续向上述平衡体系M中通入0.4molCO2和0.4mol甲醇,此时浓度商=
| ||||
|
故答案为:逆向,>.
看了中国科技网2013年2月6日报...的网友还看了以下:
初中生物人体血循环·体循环·肺循环如题帮我写出循环过程呗.(从那开始的到哪,要中间经过的地方) 2020-05-13 …
求助绝热循环过程一定是可逆循环过程吗?为什么?绝热循环过程一定是可逆循环过程吗?为什么? 2020-05-14 …
下列关于柠檬酸循环过程的叙述,正确的是()A.细菌不含线粒体,不能进行柠檬酸循环B.柠檬酸循环过程 2020-07-02 …
关于碳循环和氧循环,下列说法不正确的是()A.碳循环和氧循环分别是指二氧化碳和氧气的循环B.碳循环 2020-07-22 …
下列关于水的天然循环的说法中正确的是()①水在天然循环过程中实现了水的自身净化②水的天然循环是通过水 2020-11-20 …
下列有关生物圈中碳循环的叙述,错误的是()A.碳循环的主要形式是含碳有机物B.分解者在生物圈的碳循环 2020-11-24 …
李白诗句中的“长江之水天上来,奔流到海不复返”违背的水循环过程是A.陆地内循环过程B.海陆间水循环过 2020-11-26 …
关于血液循环的叙述中,错误的是()A.体循环与肺循环这两部分构成了完整的循环路线B.先进行肺循环,再 2021-01-13 …
李白诗句中的“长江之水天上来,奔流到海不复返”违背的水循环过程是A.陆地内循环过程B.海陆间水循环过 2021-01-27 …
下列与血液循环相关的叙述错误的是()A.血液循环途径由体循环和肺循环组成B.肺循环过程进行气体交换, 2021-02-05 …