早教吧作业答案频道 -->化学-->
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大.A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A
题目详情
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大.A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族.回答下列问题:
(1)A、B、C第一电离能由大到小的顺序为:___(用元素符号表示).
(2)B与C形成的二元化合物中,属于非极性分子的是:___(填化学式);该分子中心原子的杂化类型为:___.
(3)A、C元素形成的常见含氧酸中,分子的中心原子的价层电子对数为4的酸是___;(填化学式,下同)酸根呈平面三角形的酸是___.
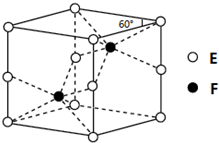
(4)E和F形成的一种化合物的晶体结构如图所示,则该化合物的化学式为___;F的配位数为___.
(5)D的离子可以形成多种配合物,由Dn+、Br-、C的最高价含氧酸根和A的简单氢化物形成的1:1:1:5的某配合物,向该配合物的溶液中滴加AgNO3溶液产生淡黄色沉淀,滴加BaCl2溶液无现象,则该配合物的化学式为:___;n值为___;Dn+的基态电子排布式为:___.

(1)A、B、C第一电离能由大到小的顺序为:___(用元素符号表示).
(2)B与C形成的二元化合物中,属于非极性分子的是:___(填化学式);该分子中心原子的杂化类型为:___.
(3)A、C元素形成的常见含氧酸中,分子的中心原子的价层电子对数为4的酸是___;(填化学式,下同)酸根呈平面三角形的酸是___.
(4)E和F形成的一种化合物的晶体结构如图所示,则该化合物的化学式为___;F的配位数为___.
(5)D的离子可以形成多种配合物,由Dn+、Br-、C的最高价含氧酸根和A的简单氢化物形成的1:1:1:5的某配合物,向该配合物的溶液中滴加AgNO3溶液产生淡黄色沉淀,滴加BaCl2溶液无现象,则该配合物的化学式为:___;n值为___;Dn+的基态电子排布式为:___.
▼优质解答
答案和解析
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大;B原子核外p轨道上有1对成对电子,外围电子排布为ns2np4,处于ⅥA族,A元素的单质是空气的主要成分,原子序数小于B,则A为N元素;由于C与B同主族、A与F同主族,F的原子序数大于C,则F、C不能处于同周期,F应处于C的下一周期,则B、C、F分别为二、三、四周期,故B为O元素、C为S元素、F为As;D与E同族,D、E原子序数大于S、小于As,只能为Ⅷ族元素,D元素的价电子数是其余电子数的一半,价电子数为(2+8+8)÷2=9,则D为Co,故E为Ni;
(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,第一电离能随着原子序数增大而减弱,则这三种元素第一电离能大小书顺序是N>O>S,故答案为:N>O>S;
(2)B是O、C是S元素,二者形成的三氧化硫为平面三角形,为非极性分子;三氧化硫分子中价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断S原子杂化方式为sp2,
故答案为:SO3;sp2;
(3)A是N、C是S元素,分子的中心原子的价层电子对数为4的酸有H2SO3、H2SO4;酸根呈平面三角形说明酸根离子中中心原子价层电子对个数是3且不含孤电子对,硝酸根离子为平面三角形,
故答案为:H2SO3、H2SO4;HNO3;
(4)该晶胞中As原子个数=8×
+4×
=2,Co原子个数为2,所以其化学式为CoAs;F连接6个E原子,所以其配位数是6,
故答案为:CoAs;6;
(5)Co的离子可以形成多种配合物,由Con+、Br-、S的最高价含氧酸根SO42-和A的简单氢化物NH3形成的1:1:1:5的某配合物,向该配合物的溶液中滴加AgNO3溶液产生淡黄色沉淀,说明该配合物的外界是溴离子,滴加BaCl2溶液无现象,说明硫酸根离子位于内界,氨气分子为内界,该配合物的化学式[CoSO4(NH3)5]Br;由Con+、Br-、SO42-、NH3形成的1:1:1:5的某配合物,由电荷守恒可知n=3,Con+为Co3+,Co原子失去3个电子生成Co3+,根据构造原理书写该离子核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6,
故答案为:[CoSO4(NH3)5]Br;3; 1s22s22p63s23p63d6或[Ar]3d6.
(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,第一电离能随着原子序数增大而减弱,则这三种元素第一电离能大小书顺序是N>O>S,故答案为:N>O>S;
(2)B是O、C是S元素,二者形成的三氧化硫为平面三角形,为非极性分子;三氧化硫分子中价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断S原子杂化方式为sp2,
故答案为:SO3;sp2;
(3)A是N、C是S元素,分子的中心原子的价层电子对数为4的酸有H2SO3、H2SO4;酸根呈平面三角形说明酸根离子中中心原子价层电子对个数是3且不含孤电子对,硝酸根离子为平面三角形,
故答案为:H2SO3、H2SO4;HNO3;
(4)该晶胞中As原子个数=8×
| 1 |
| 8 |
| 1 |
| 4 |
故答案为:CoAs;6;
(5)Co的离子可以形成多种配合物,由Con+、Br-、S的最高价含氧酸根SO42-和A的简单氢化物NH3形成的1:1:1:5的某配合物,向该配合物的溶液中滴加AgNO3溶液产生淡黄色沉淀,说明该配合物的外界是溴离子,滴加BaCl2溶液无现象,说明硫酸根离子位于内界,氨气分子为内界,该配合物的化学式[CoSO4(NH3)5]Br;由Con+、Br-、SO42-、NH3形成的1:1:1:5的某配合物,由电荷守恒可知n=3,Con+为Co3+,Co原子失去3个电子生成Co3+,根据构造原理书写该离子核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6,
故答案为:[CoSO4(NH3)5]Br;3; 1s22s22p63s23p63d6或[Ar]3d6.
看了A、B、C、D、E、F为元素周...的网友还看了以下:
有A、B、C、D、E五种短周期元素,其元素特征信息如下表.回答下列问题:元素编号元素特征信息A是原 2020-04-08 …
下图为我国某区域多年平均气温分布图(单位:℃),读图回答题。小题1:影响图示地区气温分布的主要因素 2020-05-01 …
A是地壳中含量最多的金属元素,A能和空气中的B反应生成一层致密的膜C,A单质放在稀硫酸中产生气体D, 2021-01-13 …
有A、B、C、D、E五种元素,A的单质是自然界中密度最小的气体;B、C分别是地壳中含量最多的非金属和 2021-02-01 …
下图是某地一日内太阳辐射、地面辐射和气温变化示意图,回答1—2题。1、该地一天中的太阳辐射强度变化取 2021-02-03 …
A、B、C、D四种元素,A元素的单质是最轻的稀有气体,可以填充气球,B元素的一种单质是自然界中最硬的 2021-02-09 …
有A、B、C、D四种元素,已知A元素的单质是最轻的气体,B元素是地壳中含量最高的金属元素,C元素能形 2021-02-09 …
(2011•新区一模)有A、B、C、D四种元素,A元素的单质是一种最轻的气体,B元素组成的一种单质是 2021-02-09 …
A、B、C、D四种元素,A元素的单质是最轻的稀有气体,可以填充气球,B元素的一种单质是自然界中最硬的 2021-02-09 …
A、B、C、D四种元素,其中A元素形成的单质是最轻的气体,B元素形成的一种单质是自然界中最硬的物质, 2021-02-09 …