早教吧作业答案频道 -->化学-->
高铁酸盐在能源、环保等方面有着广泛的用途.工业上用湿法制备高铁酸钾(K2FeO4)的流程如图1所示:工业生产过程中使用的KOH溶液和Cl2可通过电解KCl溶液得到,图2是离子交换膜法电解KCl
题目详情
高铁酸盐在能源、环保等方面有着广泛的用途.工业上用湿法制备高铁酸钾(K2FeO4)的流程如图1所示:
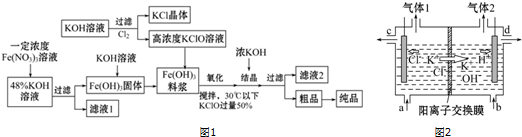
工业生产过程中使用的KOH溶液和Cl2可通过电解KCl溶液得到,图2是离子交换膜法电解KCl溶液的示意图.
(1)阳离子交换膜的作用为___.
(2)精制KCl溶液从图2中___位置补充,氢氧化钾溶液从图2中___位置流出(选填“a”“b”“c”或“d”),左侧电极连接电源的___极.
(3)电解KCl溶液过程中,氯气、KOH是按照固定的比率k(质量比)生成的产品.理论上k=___(要求写出计算表达式和结果),KOH与Cl2反应时氧化剂和还原剂质量之比为___.
(4)KClO溶液与Fe(OH)3料浆反应的离子方程式为___.
(5)上述流程中多次用到固液分离.工业上常用的固液分离设备有___(填字母).
A.分馏塔 B.离心机 C.反应釜 D.框式压滤机
(6)高铁酸钾是一种理想的水处理剂,其处理水的原理为___,___.

工业生产过程中使用的KOH溶液和Cl2可通过电解KCl溶液得到,图2是离子交换膜法电解KCl溶液的示意图.
(1)阳离子交换膜的作用为___.
(2)精制KCl溶液从图2中___位置补充,氢氧化钾溶液从图2中___位置流出(选填“a”“b”“c”或“d”),左侧电极连接电源的___极.
(3)电解KCl溶液过程中,氯气、KOH是按照固定的比率k(质量比)生成的产品.理论上k=___(要求写出计算表达式和结果),KOH与Cl2反应时氧化剂和还原剂质量之比为___.
(4)KClO溶液与Fe(OH)3料浆反应的离子方程式为___.
(5)上述流程中多次用到固液分离.工业上常用的固液分离设备有___(填字母).
A.分馏塔 B.离心机 C.反应釜 D.框式压滤机
(6)高铁酸钾是一种理想的水处理剂,其处理水的原理为___,___.
▼优质解答
答案和解析
(1)阳离子交换膜可隔绝H2和Cl2,防止二者混合发生爆炸,同时氢氧化钠在阴极产生,而氯气在阳极产生,所以还可防止Cl2与KOH溶液发生副反应,
故答案为:防止Cl2与KOH溶液发生副反应;阻止阳极产生的H2和阴极产生的Cl2混合发生爆炸;
(2)根据K+的移动方向,可以确定图中左侧为阳极室,右侧为阴极室,左侧阳极上Cl-放电生成氯气,即气体1为Cl2,该电极接电源正极,则KCl溶液应从a位置补充,右侧阴极上水电离出的H+放电生成H2,溶液中剩余的OH-与迁移过来的K+形成KOH,则KOH溶液从d位置流出,
故答案为:a;d;正;
(3)电解KCl溶液的反应为2KCl+2H2O
2KOH+H2↑+Cl2↑,产生的Cl2与KOH物质的量之比为1:2,则质量之比k=(71 g•mol-1×1 mol):(56 g•mol-1×2 mol)≈0.63,KOH与Cl2的反应为2KOH+Cl2=KCl+KClO+H2O,该反应中Cl2既是氧化剂又是还原剂,氯元素化合价一部分从0价升高到+1价,一部分降低到-1价,所以氧化剂和还原剂质量之比为1:1,
故答案为:0.63;1:1;
(4)碱性条件下KClO溶液与Fe(OH)3料浆反应生成K2FeO4,反应的离子方程式为3ClO-+4OH-+2Fe(OH)3=2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+4OH-+2Fe(OH)3=2FeO42-+3Cl-+5H2O;
(5)分馏塔是用于分离互溶液体的设备,离心机可利用离心力使液体中的固体沉降,达到固液分离的目的,反应釜为发生反应的设备,框式压滤机可以使物料中的水通过挤压而排出,达到固液分离的目的,故选B、D;
(6)高铁酸钾中Fe的化合价处于+6价,具有强氧化性,可消毒杀菌;其还原产物Fe3++在溶液中可形成Fe(OH)3胶体具有净水作用,
故答案为:高铁酸钾有强氧化性,能杀菌消毒;产生的Fe(OH)3胶体有吸附性,具有净水作用.
故答案为:防止Cl2与KOH溶液发生副反应;阻止阳极产生的H2和阴极产生的Cl2混合发生爆炸;
(2)根据K+的移动方向,可以确定图中左侧为阳极室,右侧为阴极室,左侧阳极上Cl-放电生成氯气,即气体1为Cl2,该电极接电源正极,则KCl溶液应从a位置补充,右侧阴极上水电离出的H+放电生成H2,溶液中剩余的OH-与迁移过来的K+形成KOH,则KOH溶液从d位置流出,
故答案为:a;d;正;
(3)电解KCl溶液的反应为2KCl+2H2O
| ||
故答案为:0.63;1:1;
(4)碱性条件下KClO溶液与Fe(OH)3料浆反应生成K2FeO4,反应的离子方程式为3ClO-+4OH-+2Fe(OH)3=2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+4OH-+2Fe(OH)3=2FeO42-+3Cl-+5H2O;
(5)分馏塔是用于分离互溶液体的设备,离心机可利用离心力使液体中的固体沉降,达到固液分离的目的,反应釜为发生反应的设备,框式压滤机可以使物料中的水通过挤压而排出,达到固液分离的目的,故选B、D;
(6)高铁酸钾中Fe的化合价处于+6价,具有强氧化性,可消毒杀菌;其还原产物Fe3++在溶液中可形成Fe(OH)3胶体具有净水作用,
故答案为:高铁酸钾有强氧化性,能杀菌消毒;产生的Fe(OH)3胶体有吸附性,具有净水作用.
看了高铁酸盐在能源、环保等方面有着...的网友还看了以下:
下列关于有机物的用途,说法不正确的是 A.甲烷是一种热量高、污染小的清洁能源 B.乙烯最重要的用途 2020-05-16 …
matlab中用牛顿下山法求方程的根想用牛顿下山法求一个含有一个未知数w的方程的根.假如矩阵为A, 2020-05-17 …
岩盐的用途请问各位学者岩盐除了可以做装饰物以外还有什么用途可以做其他的添加剂吗它的工业用途是什么做 2020-05-17 …
OK了,选择A,先把分子上面的通分,然后罗比得法则,分子分母对h求导,直接得出来的式子就是h趋近无 2020-06-05 …
二次函数.y=a(x-h)²和y=a(x-h)²+k顶点坐标和对称轴的求法?是求法求法!!! 2020-06-12 …
如图装置,有贮气、洗气等多种用途.以下有关该装置用途的说法中正确的是()A.用排水法收集O2,瓶内 2020-07-03 …
如图装置有贮气、洗气等多种用途.以下有关该装置用途的说法正确的是()A.用排空气法收集O2,气体从 2020-07-03 …
H这咯字母有好多种读法和意思我都弄不明怎么有这么多?如题有人是H是那种XXX的说法..也有别的说法 2020-07-15 …
mc/h是什么单位?英文怎么写的?主要用途是什么? 2020-07-20 …
部分化学键的键能数据如表:化学键H-HF-FH-FH-ClH-1E(kJ/mol)436.0157 2020-07-21 …