已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中A.水的电离程度先减小再增大B.始终增大C.n(CH3COOH)
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度先减小再增大
B.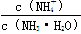 始终增大
始终增大
C.n (CH3COOH)与n (CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,溶液的PH一定为7
分 析:
A. 醋酸电离:CH3COOH CH3COO-+H+,一水合氨电离:NH3H2O NH4++OH-,H2O的电离:H2O H++OH-,所以开始滴加氨水时,中和了醋酸电离出的H+使水的电离程度增大,当二者恰好完全反应后,再滴加氨水,会抑制水的电离,使其电离程度减小,A错误;B、因为NH3H2O的电离常数Kb= c(OH-)c(NH4+)/c(NH3H2O),所以c(NH4+)/c(NH3H2O)=Kb/c(OH-),因为Kb不变,c(OH-)逐渐增大,所以c(NH4+)/c(NH3H2O)始终减小,故B错误;C、根据原子守恒,n(CH3COOH)与n(CH3COO)之和是定值,故C正确;D、当加入氨水的体积为10mL时,CH3COOH和NH3H2O恰好完全反应,因为CH3COOH和NH3H2O 的电离常数相等, 则同浓度NH4+和CH3COO的水解程度相等,所以CH3COONH4呈中性,但由于不知温度,PH不能确定,故D错误。
考点:
了解水的电离,离子积常数。了解弱电解质在水中的电离平衡及影响因素和电离常数的意义。
已知硝酸钠50C时的溶解度是114克/100克水.在50C时,往100克硝酸钠饱和溶液中加50克水 2020-04-09 …
1.已知30℃时,氯酸钾的溶解度是10g/100g水,现在30℃时,将500g氯酸钾饱和溶液蒸发去 2020-04-09 …
取Cu-Zn合金10g,放入烧杯中,再向其中加入93.7g某稀盐酸恰好完全反应后,测得烧杯内剩余物 2020-05-02 …
已知20℃时Fe(OH)3的溶解度是3×10-9g,难溶于水,在pH=7~8时可将Fe3+完全生成 2020-05-13 …
已知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随PH的升高,Fe(OH)3首先析出,为除 2020-05-13 …
已知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随PH的升高,Fe(OH)3首先析出,为除 2020-05-13 …
已知20摄氏度时,CuSO4的溶解度为20g/100g水 (1)配制20摄氏度500gCuSO4的 2020-05-16 …
已知20℃时,食盐的溶解度为36g.把20℃时含溶剂85g的食盐溶液蒸发掉10g水,然后冷却到20 2020-05-24 …
室温下,单质A.B.C分别为固体.黄绿色气体.无色气体,再合适反应条件吓,它们可以按图进行反应.又 2020-06-23 …
20℃时,KNO3的溶解度为31.6g.把40gLNO3放入小烧杯中,然后再加100g水不断搅拌, 2020-06-27 …