早教吧作业答案频道 -->化学-->
氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.某同学选择下列装置用氯化
题目详情
氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2.
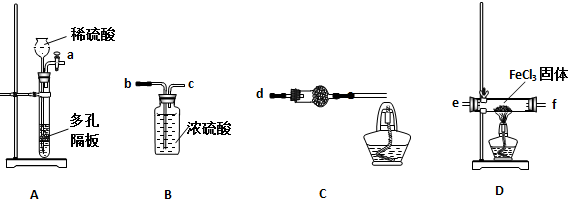
(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:___
(2)气流从左至右,装置接口连接顺序是a___
(3)装置C中干燥管中所盛试剂的名称是:___,作用是:___
(4)装置D中发生的化学方程式是:___
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
①写出滴定过程中所发生的2个离子方程式___,___
②样品中氯化亚铁的质量分数为___.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2.

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:___
(2)气流从左至右,装置接口连接顺序是a___
(3)装置C中干燥管中所盛试剂的名称是:___,作用是:___
(4)装置D中发生的化学方程式是:___
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
②样品中氯化亚铁的质量分数为___.
▼优质解答
答案和解析
(1)装置气密性的检验,利用长颈漏斗检验使用注水法,加入水形成一段水柱且保持不变,关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好;
故答案为:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好;
(2)装置的连接顺序是利用装置A生成氢气通过浓硫酸干燥后通入装置D中的玻璃管中加热反应,在加热条件下氢气还原氯化铁生成FeCl2和HCl,剩余氢气通过装置C点燃处理,气流从左至右,装置接口连接顺序是a b c e f d;
故答案为:b c e f d;
(3)装置C中碱石灰或生石灰吸收生成的氯化氢,故C中干燥管应盛放碱石灰作用除去HCl、并防止空气中水的进入;
故答案为:碱石灰或生石灰,除去HCl、并防止空气中水的进入;
(4)装置D发生的反应为氢气与氯化铁发生氧化还原反应生成氯化亚铁和氯化氢,反应为:2FeCl3+H2
2HCl+2FeCl2;
故答案为:2FeCl3+H2
2HCl+2FeCl2;
(5)①滴定过程的反应为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
故答案为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
②图表数据分析可知第三次滴定数值误差太大离子物质的量舍去,依据第一次和第二次滴定结果计算高锰酸钾溶液的平均体积,V=
ml=24ml,
根据反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
设FeCl3与FeCl2物质的量分别为x、y,Fe2+为ymol,Cl-为(3x+2y)mol
+
=1.00mol•L-1×0.024L
162.5x+127y=5.435
解得x=0.1 y=0.3,计算得到氯化亚铁的质量分数=
×100%=70.1%;
故答案为:70.1%.
故答案为:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好;
(2)装置的连接顺序是利用装置A生成氢气通过浓硫酸干燥后通入装置D中的玻璃管中加热反应,在加热条件下氢气还原氯化铁生成FeCl2和HCl,剩余氢气通过装置C点燃处理,气流从左至右,装置接口连接顺序是a b c e f d;
故答案为:b c e f d;
(3)装置C中碱石灰或生石灰吸收生成的氯化氢,故C中干燥管应盛放碱石灰作用除去HCl、并防止空气中水的进入;
故答案为:碱石灰或生石灰,除去HCl、并防止空气中水的进入;
(4)装置D发生的反应为氢气与氯化铁发生氧化还原反应生成氯化亚铁和氯化氢,反应为:2FeCl3+H2
| ||
故答案为:2FeCl3+H2
| ||
(5)①滴定过程的反应为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
故答案为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
②图表数据分析可知第三次滴定数值误差太大离子物质的量舍去,依据第一次和第二次滴定结果计算高锰酸钾溶液的平均体积,V=
| 25.03-1.04+25.99-1.98 |
| 2 |
根据反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
设FeCl3与FeCl2物质的量分别为x、y,Fe2+为ymol,Cl-为(3x+2y)mol
| y |
| 5 |
| 3x+2y |
| 5 |
162.5x+127y=5.435
解得x=0.1 y=0.3,计算得到氯化亚铁的质量分数=
| 0.03mol×127g/mol |
| 5.435g |
故答案为:70.1%.
看了氯化亚铁具有独有的脱色能力,适...的网友还看了以下:
下列物质性质与应用对应关系不正确的是()A.氯化钙是中性干燥剂,可用于实验室干燥氨气B.二氧化氯具 2020-05-12 …
但选择二氧化氯反应器时,不是按能产生多少毫克二氧化氯算的吗,怎么按水量计算出需要多少二氧化氯 2020-05-17 …
粗盐易潮解,这是因为A.氯化钠具有吸水性B.氯化钠易溶于水中C.含有氯化钙和氯化镁等杂质D.含有氢 2020-05-17 …
臭氧(03).氯(Cl2),二氧化氯(Cl202)的检验,假设通通都混在一起那摸要如何证明说她有这 2020-05-22 …
物质的性质决定其用途.下列说法正确的是()A.二氧化氯具有强氧化性,可用来漂白织物B.氯化铝是强电解 2020-11-03 …
(2014•珠海二模)下列叙述中正确的是()A.二氧化氯具有还原性,可用于自来水的杀菌消毒B.碳酸钠 2020-11-12 …
二氧化氯具有还原性,可用于自来水的杀菌消毒.这句话为什么不正确? 2020-12-01 …
下列叙述中正确的是A.二氧化氯具有还原性,可用于自来水的杀菌消毒B.碳酸钠溶液呈碱性,医疗上常用碳酸 2020-12-14 …
下列有关物质的性质与应用相对应的是()A.SO2具有氧化性,可用于漂白纸浆B.氢氟酸具有酸性,可用于 2021-01-12 …
下列物质性质与应用对应关系不正确的是()A.生石灰能与水反应,可用于实验室干燥氯气B.二氧化氯具有强 2021-02-13 …