早教吧作业答案频道 -->化学-->
Cl2及其化合物在生产、生活中有广泛用途,回答下列问题.(1)氯气溶于水得到氯水,氯水中含有氯元素并且具有氧化性的微粒有.(2)新制氯水体系中,存在多个含氯元素之间的平衡
题目详情
Cl2及其化合物在生产、生活中有广泛用途,回答下列问题.
(1)氯气溶于水得到氯水,氯水中含有氯元素并且具有氧化性的微粒有___.
(2)新制氯水体系中,存在多个含氯元素之间的平衡关系,请写出任意两个平衡关系:___.
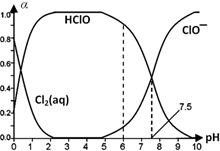
(3)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-三种微粒分别所占分数(α)随pH变化的关系如图所示.
已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与pH=6时杀菌效果较强的是pH=___.
(4)ClO2是一种更高效的杀菌消毒剂,工业上可用电解法制备ClO2,方法如下:在80℃时电解氯化钠饱和溶液得到NaClO3,然后与盐酸反应得到ClO2.电解时,产生ClO3-的电极是___极,生成ClO3-的电极反应式为___.
(5)已知PCl5的热分解反应为:PCl5(g)⇌PCl3(g)+Cl2(g),某温度下,在固定容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.15mol/L.
①上述反应达到平衡后继续向容器充入PCl5,则上述平衡将___移动(填“正向”、“逆向”或“不”),PCl5的转化率将___(填“增大”、“减小”或“不变”).
②计算该温度下PCl5(g)⇌PCl3(g)+Cl2(g)的平衡常数K(写出计算过程).

(1)氯气溶于水得到氯水,氯水中含有氯元素并且具有氧化性的微粒有___.
(2)新制氯水体系中,存在多个含氯元素之间的平衡关系,请写出任意两个平衡关系:___.
(3)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-三种微粒分别所占分数(α)随pH变化的关系如图所示.
已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与pH=6时杀菌效果较强的是pH=___.
(4)ClO2是一种更高效的杀菌消毒剂,工业上可用电解法制备ClO2,方法如下:在80℃时电解氯化钠饱和溶液得到NaClO3,然后与盐酸反应得到ClO2.电解时,产生ClO3-的电极是___极,生成ClO3-的电极反应式为___.
(5)已知PCl5的热分解反应为:PCl5(g)⇌PCl3(g)+Cl2(g),某温度下,在固定容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.15mol/L.
①上述反应达到平衡后继续向容器充入PCl5,则上述平衡将___移动(填“正向”、“逆向”或“不”),PCl5的转化率将___(填“增大”、“减小”或“不变”).
②计算该温度下PCl5(g)⇌PCl3(g)+Cl2(g)的平衡常数K(写出计算过程).
▼优质解答
答案和解析
(1)氯气溶于水,部分与水反应生成氯化氢和次氯酸,次氯酸部分电离,氯化氢完全电离,所以氯水中含有氯元素并且具有氧化性的微粒,Cl2、HClO、ClO-中氯元素化合价都可以降价,都具有氧化性;
故答案为:Cl2、HClO、ClO-;
(2)氯气溶于水,部分与水反应生成氯化氢和次氯酸,方程式:Cl2(aq)+H2O HClO+H++Cl-或Cl2(aq)+H2O
HClO+H++Cl-或Cl2(aq)+H2O HClO+HCl,次氯酸部分电离生成氢离子与次氯酸根离子,电离方程式:HClO
HClO+HCl,次氯酸部分电离生成氢离子与次氯酸根离子,电离方程式:HClO H++ClO-;
H++ClO-;
故答案为:Cl2(aq)+H2O HClO+H++Cl-或Cl2(aq)+H2O
HClO+H++Cl-或Cl2(aq)+H2O HClO+HCl、HClO
HClO+HCl、HClO H++ClO-;
H++ClO-;
(3)次氯酸具有强的氧化性,具有杀菌消毒作用,依据图数据可知pH=6时,次氯酸含量较高,所以杀菌效果较强;
故答案为:6;
(4)电解氯化钠饱和溶液得到NaClO3,氯离子被氧化生成氯酸根离子,发生氧化反应,电解池中阳极发生氧化反应,电解氯化钠溶液时,阳极上氯离子失电子和水反应生成氯酸根离子和氢离子,电极反应式为:Cl--6e-+3 H2O=6H++ClO3-;
故答案为:阳;Cl--6e-+3 H2O=6H++ClO3-;
(5)①在保持容器体积不变的条件下,再充入PCl5,等效增大压强,平衡向体积减小的方向移动,反应物转化率减小;
故答案为:逆向,减小;
②PCl5(g)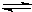 PCl3 (g)+Cl2(g)
PCl3 (g)+Cl2(g)
起始浓度(mol/L) 0.20 0 0
转化浓度(mol/L) 0.15 0.15 0.15
平衡浓度(mol/L) 0.05 0.15 0.15
由K=
=
=0.45mol/L;
故答案为:0.45mol/L.
故答案为:Cl2、HClO、ClO-;
(2)氯气溶于水,部分与水反应生成氯化氢和次氯酸,方程式:Cl2(aq)+H2O
 HClO+H++Cl-或Cl2(aq)+H2O
HClO+H++Cl-或Cl2(aq)+H2O HClO+HCl,次氯酸部分电离生成氢离子与次氯酸根离子,电离方程式:HClO
HClO+HCl,次氯酸部分电离生成氢离子与次氯酸根离子,电离方程式:HClO H++ClO-;
H++ClO-;故答案为:Cl2(aq)+H2O
 HClO+H++Cl-或Cl2(aq)+H2O
HClO+H++Cl-或Cl2(aq)+H2O HClO+HCl、HClO
HClO+HCl、HClO H++ClO-;
H++ClO-;(3)次氯酸具有强的氧化性,具有杀菌消毒作用,依据图数据可知pH=6时,次氯酸含量较高,所以杀菌效果较强;
故答案为:6;
(4)电解氯化钠饱和溶液得到NaClO3,氯离子被氧化生成氯酸根离子,发生氧化反应,电解池中阳极发生氧化反应,电解氯化钠溶液时,阳极上氯离子失电子和水反应生成氯酸根离子和氢离子,电极反应式为:Cl--6e-+3 H2O=6H++ClO3-;
故答案为:阳;Cl--6e-+3 H2O=6H++ClO3-;
(5)①在保持容器体积不变的条件下,再充入PCl5,等效增大压强,平衡向体积减小的方向移动,反应物转化率减小;
故答案为:逆向,减小;
②PCl5(g)
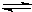 PCl3 (g)+Cl2(g)
PCl3 (g)+Cl2(g)起始浓度(mol/L) 0.20 0 0
转化浓度(mol/L) 0.15 0.15 0.15
平衡浓度(mol/L) 0.05 0.15 0.15
由K=
| c(PCl3)×c(Cl2) |
| c(PCl5) |
| 0.15mol/L×0.15mol/L |
| 0.05mol/L |
故答案为:0.45mol/L.
看了Cl2及其化合物在生产、生活中...的网友还看了以下:
求老师解答:根据情境回答最得体的根据情境回答最得体的一项是[]你的同学送你一张足球比赛的入场券,约 2020-05-13 …
常温常压下,又通过什么比出气体体积大小?不要天天作业答疑网的破枪手来回答,一回答就举报你 2020-05-17 …
请尤其具体解释--谁、、、与,的含义.警告某些回答者,你要回答就回答,晕什么你晕?我又没求着你回答 2020-06-17 …
一瓶由氢气和氯气组成的混合气体90ml,经光照后恢复原状态时测得反应前后体积不变回答以下问题1)上 2020-06-27 …
怎样才能判断一个物体是否可以看成质点?请各位回答者回答清楚点,好吗?能有多清楚就回答多清楚,我一直都 2020-11-16 …
请回答氯碱的如下问题:(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= 2020-11-29 …
请回答氯碱工业中的如下问题:(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论 2020-11-29 …
Cl2及其化合物在生产、生活中有广泛用途,回答下列问题.(1)氯气溶于水得到氯水,氯水中含有氯元素并 2020-12-02 …
四个选项,如何计算总体满意率比如说100个人回答,回答满意70人,其他三项各有10人回答,计算总体满 2020-12-03 …
右图是利用排水法收集好的某无色气体.请椐此回答该气体应具有的物理性质(回答两条即可,不能再回答“无色 2021-01-22 …