早教吧作业答案频道 -->化学-->
氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图:(1)请写出步骤一中发生反应的化学方程式:(任写一个)(2)溶液A中所含的
题目详情
氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图:
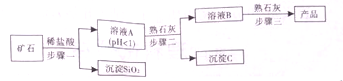
(1)请写出步骤一中发生反应的化学方程式:___(任写一个)
(2)溶液A中所含的阳离子有___(填离子符号)
(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见表
步骤二中加入熟石灰,调节溶液的pH范围为___
(4)3个步骤中均用到的操作是___
(5)步骤三中生成产品的化学方程式为___.

(1)请写出步骤一中发生反应的化学方程式:___(任写一个)
(2)溶液A中所含的阳离子有___(填离子符号)
(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见表
| 沉淀物 | Fe(OH)2 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.9 | 4.2 | 9.1 |
| 完全沉淀 | 3.2 | 6.7 | 11.1 |
(4)3个步骤中均用到的操作是___
(5)步骤三中生成产品的化学方程式为___.
▼优质解答
答案和解析
(1)氧化镁(氧化铁、氧化铜)和盐酸反应生成氯化镁(氯化铁、氯化铜)和水,故化学方程式为MgO+2HCl═MgCl2+H2O、Fe2O3+6HCl═2FeCl3+3H2O、CuO+2HCl═CuCl2+H2O,
(2)溶液A中共含有4种阳离子,它们是Mg2+、Fe3+、Cu2+、H+;
(3)为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为6.7~9.1,即必须把pH控制在氯化铜能完全沉淀、但氯化镁不能沉淀的范围内.故填:6.7~9.1.
(4)3个步骤中均用到的操作是过滤;
(5)氯化镁和氢氧化钙反应能生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:
MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
答案:
(1)MgO+2HCl═MgCl2+H2O;
(2)Mg2+、Fe3+、Cu2+、H+;
(3)6.7~9.1;
(4)过滤
(5)MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
(1)氧化镁(氧化铁、氧化铜)和盐酸反应生成氯化镁(氯化铁、氯化铜)和水,故化学方程式为MgO+2HCl═MgCl2+H2O、Fe2O3+6HCl═2FeCl3+3H2O、CuO+2HCl═CuCl2+H2O,
(2)溶液A中共含有4种阳离子,它们是Mg2+、Fe3+、Cu2+、H+;
(3)为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为6.7~9.1,即必须把pH控制在氯化铜能完全沉淀、但氯化镁不能沉淀的范围内.故填:6.7~9.1.
(4)3个步骤中均用到的操作是过滤;
(5)氯化镁和氢氧化钙反应能生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:
MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
答案:
(1)MgO+2HCl═MgCl2+H2O;
(2)Mg2+、Fe3+、Cu2+、H+;
(3)6.7~9.1;
(4)过滤
(5)MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
看了氢氧化镁是一种重要的化工原料,...的网友还看了以下:
化学实验1.实验室制氧气时可以加热氯酸钾和二氧化锰的混合物,生成氯化钾的颜色是什么?2.铁在氧气中 2020-04-09 …
下列有关二氧化碳的检验、制备和用途能达到目的是()A.二氧化碳可由木炭在足量氧气中充分燃烧产生B. 2020-04-11 …
矿石中氧化铁含量含氧化铁矿石20克合一定量一氧化碳充分反映生成物使澄清石灰水浑浊使石灰水质量增加9 2020-04-26 …
第一题铁矿石的主要成分是氧化铁,某厂购进铁矿石100吨,厂部技术人员随即抽样,取10克样品,经测定 2020-06-03 …
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、 2020-06-19 …
工业上常用锻烧石灰石的方法制取二氧化碳.某工厂锻烧含碳酸钙80%的石灰石25t,求:(1)石灰石中 2020-07-06 …
对下列化学反应的分类正确的是()①硫在氧气中燃烧②铝箔在氧气中燃烧③蜡烛在氧气中燃烧④双氧水与二氧 2020-07-29 …
1.要炼出含杂质2%的铁1600吨需含氧化铁80%的赤铁矿多少吨?2.12吨石灰石与足量的稀盐酸完全 2020-11-10 …
下列4个坐标图分别表示4个实验过程中某些质量的变化,其中正确的是()A.向一定量石灰石中不断加入稀盐 2021-01-15 …
含有二氧化硅的石灰石五克和过量的盐酸反应,所得二氧化碳在标准状况下的体积为一千零六十四毫升1、求石灰 2021-01-26 …