早教吧作业答案频道 -->化学-->
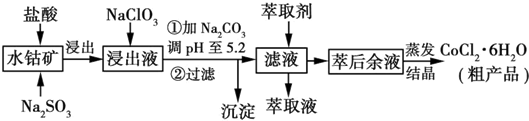
利用水钴矿[主要成分为Co2O3和Co(OH)3,还有少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如图所示:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:②部分阳离子以氢氧化
题目详情
利用水钴矿[主要成分为Co2O3和Co(OH)3,还有少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如图所示:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出浸出过程中Co2O3发生反应的离子方程式___.
(2)NaClO3的作用是___.
(3)加Na2CO3调pH至5.2所得沉淀为___.
(4)萃取剂对金属离子的萃取率与pH的关系如图所示.萃取剂的作用是___;其使用的适宜pH范围是___(填字母).
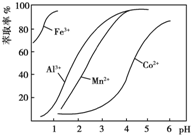
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是___(任答一条即可).

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是___.
(3)加Na2CO3调pH至5.2所得沉淀为___.
(4)萃取剂对金属离子的萃取率与pH的关系如图所示.萃取剂的作用是___;其使用的适宜pH范围是___(填字母).

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是___(任答一条即可).
▼优质解答
答案和解析
含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MnCl2,加入NaClO3氧化亚铁离子为铁离子,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2,...
看了利用水钴矿[主要成分为Co2O...的网友还看了以下:
酸性条件下20mL、0.5mol/L的KMnO4溶液可将25mL、2mol/L的FeSO4溶液中的 2020-05-02 …
下列变化需加入还原剂的是()A、HCO3-→CO2B、MnO4-→Mn2+C、FeO→Fe3O4D 2020-05-14 …
R2O8n-(负n价的八氧化二R根)在一定条件下可以把Mn2+(正2价的Mn离子)氧化为MnO4- 2020-05-14 …
(1)S2O8(2-)+Mn2+H2O→SO4(2-)+MnO4(-)+H(+)(未配平)(2)H 2020-06-16 …
1.10mlc(MnSO4)=0.0015mol/L的硫酸锰溶液中,先加入0.495g硫酸铵固体( 2020-07-05 …
将20mL0.5mol•L-1K2SO3溶液逐滴加入到20mL0.2mol•L-1硫酸酸化的紫色K 2020-07-12 …
(1)配平氧化还原反应方程式:C2O42-+MnO4-+H+=CO2+Mn2++H2O(2)称取6 2020-07-25 …
(1)将MnO4-氧化Fe2+的离子方程式补充完整:□MnO4-+□Fe2++□═□Mn2++□Fe 2020-11-05 …
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.(1)请简述如何检查该装置的 2020-11-28 …
[NH4HCO3]:[Mn2+]=1:2.5是质量比还是摩尔比?[物质1]:[物质2]通常都是代表什 2021-02-12 …