早教吧作业答案频道 -->化学-->
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题.硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要措施.Ⅰ.研究
题目详情
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题.硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要措施.
Ⅰ.研究发现利用NH3可消除硝酸工业尾气中的NO污染.NH3与NO的物质的量之比分别为1:3、3:l、4:1时,NO脱除率随温度变化的曲线如图2所示.
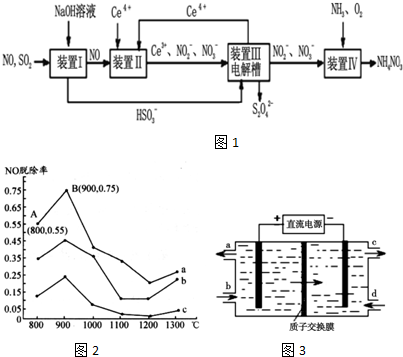
(1)①曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为___mg/(m3•s).
②曲线b对应的NH3与NO的物质的量之比是___,其理由是___
(2)已知在25℃,101kPa时:
N2(g)+3H2(g)═2NH3(g)△H=-Q1/mol
2H2(g)+O2(g)═2H2O(1)△H=-Q2kJ/mo1
N2(g)+O2(g)═2NO(g)△H=+Q3kJ/mo1;
请写出用NH3脱除NO的热化学方程式___.
Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如图1:
(3)装置Ⅱ中NO转变为NO3-的反应的离子方程式为___.
(4)装置Ⅲ制得Na2S2O4的同时还能让Ce4+再生,原理如图3所示.其阴极的电极反应式为:___.
(5)按上述流程处理含有amolSO2、bmolNO的雾霾(b>a),并制取Na2S2O4和NH4NO3.装置Ⅰ中SO2、装置Ⅱ中NO、装置Ⅲ中HSO3-和Ce3+、装置Ⅳ中NO2-全部转化,处理完毕后装置Ⅱ中Ce4+的剩余量与加入量相比没有变化,则至少需向装置Ⅳ中通入标准状况下的O2___L(用含a、b的代数式表示).
Ⅰ.研究发现利用NH3可消除硝酸工业尾气中的NO污染.NH3与NO的物质的量之比分别为1:3、3:l、4:1时,NO脱除率随温度变化的曲线如图2所示.

(1)①曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为___mg/(m3•s).
②曲线b对应的NH3与NO的物质的量之比是___,其理由是___
(2)已知在25℃,101kPa时:
N2(g)+3H2(g)═2NH3(g)△H=-Q1/mol
2H2(g)+O2(g)═2H2O(1)△H=-Q2kJ/mo1
N2(g)+O2(g)═2NO(g)△H=+Q3kJ/mo1;
请写出用NH3脱除NO的热化学方程式___.
Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如图1:
(3)装置Ⅱ中NO转变为NO3-的反应的离子方程式为___.
(4)装置Ⅲ制得Na2S2O4的同时还能让Ce4+再生,原理如图3所示.其阴极的电极反应式为:___.
(5)按上述流程处理含有amolSO2、bmolNO的雾霾(b>a),并制取Na2S2O4和NH4NO3.装置Ⅰ中SO2、装置Ⅱ中NO、装置Ⅲ中HSO3-和Ce3+、装置Ⅳ中NO2-全部转化,处理完毕后装置Ⅱ中Ce4+的剩余量与加入量相比没有变化,则至少需向装置Ⅳ中通入标准状况下的O2___L(用含a、b的代数式表示).
▼优质解答
答案和解析
Ⅰ.(1)①曲线a中,NO的起始浓度为6×10-4mg/m3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8 s,该时间段内NO的脱除速率=
=1.5×10-4mg/(m3•s),
故答案为:1.5×10-4;
②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为1:3、3:1、4:1时,对应的曲线为c、b、a,故曲线b 对应NH3与NO的物质的量之比是3:1,
故答案为:3:1;NH3与NO的物质的量比值越大,NO的脱除率越大;
(2)已知在25℃,101kPa时:
①N2(g)+3H2(g)═2NH3(g)△H=-Q1/mol
②2H2(g)+O2(g)═2H2O(1)△H=-Q2kJ/mo1
③N2(g)+O2(g)═2NO(g)△H=+Q3kJ/mo1,用NH3脱除NO的化学方程式为4 NH3(g)+6 NO(g)═5 N2(g)+6 H2O(1),可根据该寺定律,将3×②-2×①-3×③可得热化学方程式4 NH3(g)+6 NO(g)═5 N2(g)+6 H2O(1)△H=(3Q2-2Q1-3Q3)KJ/mol,
故答案为:4 NH3(g)+6 NO(g)═5 N2(g)+6 H2O(1)△H=(3Q2-2Q1-3Q3)KJ/mol;
Ⅱ.SO2、NO是大气污染物,通过氢氧化钠溶液吸收得到亚硫酸氢钠,一氧化氮不反应,通过装置Ⅱ加入Ce4+氧化还原反应得到Ce3+、NO2-、NO3-等,和亚硫酸氢钠混合,在电解池中通电电解得到Ce4+循环使用,获得Na2S2O4,NO2-、NO3-等加入氨气和氧气在装置Ⅳ中发生反应得到NH4NO3产品,
(3)装置Ⅱ中NO转变为NO3-的反应的离子方程式为3Ce4++NO+2H2O═3Ce3++NO3-+4H+,故答案为:3Ce4++NO+2H2O═3Ce3++NO3-+4H+;
(4)阴极发生还原反应,电极方程式为2HSO3-+2e-+2H+═S2O42-+2H2O,故答案为:2HSO3-+2e-+2H+═S2O42-+2H2O;
(5)amolSO2、bmolNO反应后分别生成Na2S2O4、NH4NO3,S元素化合价由+4价降低到+3价,N元素化合价由+2价升高到+5价,设通入xmol氧气,
由化合价升降总数相等可知4x+a=3b,x=
,则氧气的体积为
mol×22.4L/mol=5.6(3b-a)L,
故答案为:5.6(3b-a).
| (75%-55%)×6×10-4 |
| 0.8s |
故答案为:1.5×10-4;
②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为1:3、3:1、4:1时,对应的曲线为c、b、a,故曲线b 对应NH3与NO的物质的量之比是3:1,
故答案为:3:1;NH3与NO的物质的量比值越大,NO的脱除率越大;
(2)已知在25℃,101kPa时:
①N2(g)+3H2(g)═2NH3(g)△H=-Q1/mol
②2H2(g)+O2(g)═2H2O(1)△H=-Q2kJ/mo1
③N2(g)+O2(g)═2NO(g)△H=+Q3kJ/mo1,用NH3脱除NO的化学方程式为4 NH3(g)+6 NO(g)═5 N2(g)+6 H2O(1),可根据该寺定律,将3×②-2×①-3×③可得热化学方程式4 NH3(g)+6 NO(g)═5 N2(g)+6 H2O(1)△H=(3Q2-2Q1-3Q3)KJ/mol,
故答案为:4 NH3(g)+6 NO(g)═5 N2(g)+6 H2O(1)△H=(3Q2-2Q1-3Q3)KJ/mol;
Ⅱ.SO2、NO是大气污染物,通过氢氧化钠溶液吸收得到亚硫酸氢钠,一氧化氮不反应,通过装置Ⅱ加入Ce4+氧化还原反应得到Ce3+、NO2-、NO3-等,和亚硫酸氢钠混合,在电解池中通电电解得到Ce4+循环使用,获得Na2S2O4,NO2-、NO3-等加入氨气和氧气在装置Ⅳ中发生反应得到NH4NO3产品,
(3)装置Ⅱ中NO转变为NO3-的反应的离子方程式为3Ce4++NO+2H2O═3Ce3++NO3-+4H+,故答案为:3Ce4++NO+2H2O═3Ce3++NO3-+4H+;
(4)阴极发生还原反应,电极方程式为2HSO3-+2e-+2H+═S2O42-+2H2O,故答案为:2HSO3-+2e-+2H+═S2O42-+2H2O;
(5)amolSO2、bmolNO反应后分别生成Na2S2O4、NH4NO3,S元素化合价由+4价降低到+3价,N元素化合价由+2价升高到+5价,设通入xmol氧气,
由化合价升降总数相等可知4x+a=3b,x=
| 3b-a |
| 4 |
| 3b-a |
| 4 |
故答案为:5.6(3b-a).
看了污染物的有效去除和资源的充分利...的网友还看了以下:
硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeS 2020-05-14 …
硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeS 2020-05-14 …
连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.Ⅰ.查 2020-06-17 …
火力发电厂和硫酸厂是大气中二氧化硫重要的污染源.科学证明,森林能吸收二氧化硫等有害气体及工业粉尘. 2020-06-21 …
硫酸铵是一种氮肥,也是重要的化工原料,硫酸铵在513℃以上完全分解,某课题小组设计实验探究硫酸铵的分 2020-11-04 …
(14分)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。(1)将烧碱 2020-11-28 …
(14分)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。(1)将烧碱 2020-11-28 …
(10分)Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。(1)将烧 2020-11-28 …
硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.(1)将烧碱吸收H2S 2020-11-28 …
某班有7门课程,星期一上午的四节课必须有数字和英语,并且要求数学课排在英语课之前,则星期一上午没有重 2020-11-28 …