早教吧作业答案频道 -->化学-->
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题.某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除
题目详情
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题.
某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略).
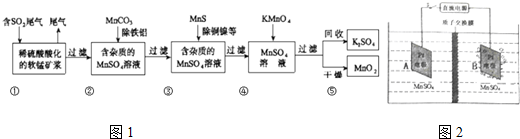
请回答下列问题:
(1)上述流程脱硫实现了___(选填下列字母编号).
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)流程图④过程中发生的主要化学反应的方程式为___.
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是___,用MnS除去溶液中的Cu2+的离子方程式为___.
(4)MnO2可作超级电容器材料.工业上用如图2所示装置制备MnO2.接通电源后,A电极的电极反应式为:___,当制备1mol MnO2,则膜两侧电解液的质量变化差(△m左-△m右)为___g.
(5)假设脱除的SO2只与软锰矿浆中的MnO2反应.按照如图1示流程,将am3 (标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为67.2%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2___ kg.
某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略).

请回答下列问题:
(1)上述流程脱硫实现了___(选填下列字母编号).
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)流程图④过程中发生的主要化学反应的方程式为___.
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是___,用MnS除去溶液中的Cu2+的离子方程式为___.
(4)MnO2可作超级电容器材料.工业上用如图2所示装置制备MnO2.接通电源后,A电极的电极反应式为:___,当制备1mol MnO2,则膜两侧电解液的质量变化差(△m左-△m右)为___g.
(5)假设脱除的SO2只与软锰矿浆中的MnO2反应.按照如图1示流程,将am3 (标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为67.2%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2___ kg.
▼优质解答
答案和解析
由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3调节溶液pH,使溶液中Al3+和Fe3+转化为沉淀,过滤除去,MnS将铜、镍离子还原为单质,过滤分离,滤液中加入高锰酸钾与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰.
(1)流程脱硫实现了废弃物的综合利用、酸雨的减少,与白色污染无关,
故答案为:AC;
(2)高锰酸钾与硫酸锰反应生成二氧化锰,还生成硫酸钾,由元素守恒可知还生成硫酸,反应方程式为:2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2 H2SO4,
故答案为:2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2 H2SO4;
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀,用MnS除去溶液中的Cu2+的离子方程式为:MnS(s)+Cu2+(aq)=CuS(s)+Mn2+(aq),
故答案为:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀;MnS(s)+Cu2+(aq)=CuS(s)+Mn2+(aq);
(4)MnO2可作超级电容器材料.电解硫酸锰溶液制备MnO2,Mn元素发生氧化反应,由装置图可知,B电极上有气体生成,发生还原反应,应是氢离子放电生成氢气,A为阳极,阳极上是Mn2+失去电子得到MnO2,由电荷守恒可知还有H+生成,氢离子通过质子交换膜移向右室,阳极电极反应式为:Mn2++2H2O-2e-=MnO2+4H+,根据电子转移可知移向右室的氢离子生成氢气,右室电解质溶液质量不变,两侧电解液的质量变化差为二氧化锰与移向右室氢离子的质量,当制备1mol MnO2,转移电子为2mol,则移向右室的氢离子为2mol,则膜两侧电解液的质量变化差(△m左-△m右)为1mol×87g/mol+2mol×1g/mol=89g,
故答案为:Mn2++2H2O-2e-=MnO2+4H+;89;
(5)被吸收的SO2转化为MnSO4,二者物质的量相等,除去铁、铝、铜、镍等杂质时碳酸锰也转化为MnSO4,④中发生反应:2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2 H2SO4,可得关系式:3SO2~3MnSO4~5MnO2,由关系式可知n(MnSO4)=
×
,则引入的Mn元素为
×
-
×b%×67.2%,由Mn元素守恒可知相当于引入的二氧化锰物质的量为(
×
-
×b%×67.2%),则其质量为(
×
-
×b%×67.2%)×87g/mol=(600c-26.1ab)g,即其质量为(0.6c-0.0261ab) Kg,
故答案为:(0.6c-0.0261ab).
(1)流程脱硫实现了废弃物的综合利用、酸雨的减少,与白色污染无关,
故答案为:AC;
(2)高锰酸钾与硫酸锰反应生成二氧化锰,还生成硫酸钾,由元素守恒可知还生成硫酸,反应方程式为:2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2 H2SO4,
故答案为:2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2 H2SO4;
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀,用MnS除去溶液中的Cu2+的离子方程式为:MnS(s)+Cu2+(aq)=CuS(s)+Mn2+(aq),
故答案为:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀;MnS(s)+Cu2+(aq)=CuS(s)+Mn2+(aq);
(4)MnO2可作超级电容器材料.电解硫酸锰溶液制备MnO2,Mn元素发生氧化反应,由装置图可知,B电极上有气体生成,发生还原反应,应是氢离子放电生成氢气,A为阳极,阳极上是Mn2+失去电子得到MnO2,由电荷守恒可知还有H+生成,氢离子通过质子交换膜移向右室,阳极电极反应式为:Mn2++2H2O-2e-=MnO2+4H+,根据电子转移可知移向右室的氢离子生成氢气,右室电解质溶液质量不变,两侧电解液的质量变化差为二氧化锰与移向右室氢离子的质量,当制备1mol MnO2,转移电子为2mol,则移向右室的氢离子为2mol,则膜两侧电解液的质量变化差(△m左-△m右)为1mol×87g/mol+2mol×1g/mol=89g,
故答案为:Mn2++2H2O-2e-=MnO2+4H+;89;
(5)被吸收的SO2转化为MnSO4,二者物质的量相等,除去铁、铝、铜、镍等杂质时碳酸锰也转化为MnSO4,④中发生反应:2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2 H2SO4,可得关系式:3SO2~3MnSO4~5MnO2,由关系式可知n(MnSO4)=
| 3 |
| 5 |
| 1000cg |
| 87g/mol |
| 3 |
| 5 |
| 1000cg |
| 87g/mol |
| 1000aL |
| 22.4L/mol |
| 3 |
| 5 |
| 1000cg |
| 87g/mol |
| 1000aL |
| 22.4L/mol |
| 3 |
| 5 |
| 1000cg |
| 87g/mol |
| 1000aL |
| 22.4L/mol |
故答案为:(0.6c-0.0261ab).
看了污染物的有效去除和资源的充分利...的网友还看了以下:
1.根据是否有新物质生成,把变化分为化学变化和物理变化.2.根据能否使酚酞变色,可以将溶液分为酸溶 2020-05-21 …
化合物V是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。化合物V也可通过下图所示方法合成: 2020-06-24 …
鼻腔前部生有,它有作用;鼻腔内表面有,可以分泌,黏液有和作用;黏膜中还分布鼻腔前部生有,它有作用; 2020-07-06 …
磷是存在于自然界和生物体内的重要元素,回答下列与磷及其化合物有关的问题。(1)磷在自然界里主要以的 2020-07-29 …
关于同分异构体分子式为C9H10Br2的芳香族化合.物有多种同分异构体,同时满足苯环上有两个取代基, 2020-10-31 …
关于文化的叙述,正确的是[]A.文化有广义文化和狭义文化之分,我们所了解的文化是狭义文化B.文化形态 2020-12-08 …
关于文化的叙述,正确的是[]A.文化有广义文化和狭义文化之分,我们所了解的文化是狭义文化B.文化形态 2020-12-08 …
碳单质及其化合物有广泛的应用.(1)碳的同素异性体金刚石、石墨和C60晶体中,能溶于有机溶剂的是,原 2020-12-18 …
据图所示的化合物的结构简式,回答下列问题:(1)该化合物有个羧基.(2)该化合物有种氨基酸,氨基酸的 2020-12-21 …
有关化学物质对环境的影响,下列叙述错误的是()A.汽车的高温引擎产生氮的氧化物,直接排放会造成空气污 2020-12-30 …