早教吧作业答案频道 -->化学-->
实现节能减排和低碳经济的一项重要课题就是研究如何将CO2转化为可利用的资源,目前工业上有一种方法是用CO2来生产燃料甲醇,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
题目详情
实现节能减排和低碳经济的一项重要课题就是研究如何将CO2转化为可利用的资源,目前工业上有一种方法是用CO2来生产燃料甲醇,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ/mol)的变化,据此回答下列有关问题:
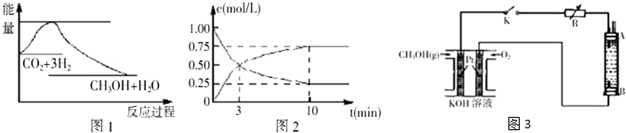
(1)25℃时,1.01×105Pa,16g液态甲醇完全燃烧,当恢复到原状态时放出363.3kJ的热量,写出该反应的热化学方程式___.
(2)为探究反应原理,现进行如下实验:某温度下,在体积为lL的密闭容器中充入lmolCO2和4molH2,一定条件下发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2的浓度随时间变化如图2所示.
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___;H2的转化率为___.
②若向该容器中加入 amolCO2、bmolH2、cmolCH3OH(g)和dmolH2O(g),且a、b、c、d均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同,试比较反应放出的能量:①___②(填“大于”“小于”或“等于”)
③下列措施中能使H2的转化率提高的是___(填字母).
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.相同条件下 再充入lmolCO2和4molH2
(3)甲醇是一种可再生能源具有广泛的开发和应用前景.某实验小组用一种以甲醇为原料的燃料电池作为电源,设计了一种电解法制取Fe(OH)2的实验装置如图3所示,通电后溶液中产生大量白色沉淀且较长时间不变色.
①该燃料电池的负极反应为___.
②下列说法中正确的是___(填序号)
A.电源中的负极附近 pH升高
B.电极B的发生氧化反应
C.A、B两端都必须用铁作电极
D.阴极发生的反应是2H++2e-=H2↑
E.电解的电解质溶液可以是CuSO4溶液
③若电池中甲醇的通入量为8g,且反应完全,则理论上最多能产生沉淀___g.

(1)25℃时,1.01×105Pa,16g液态甲醇完全燃烧,当恢复到原状态时放出363.3kJ的热量,写出该反应的热化学方程式___.
(2)为探究反应原理,现进行如下实验:某温度下,在体积为lL的密闭容器中充入lmolCO2和4molH2,一定条件下发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2的浓度随时间变化如图2所示.
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___;H2的转化率为___.
②若向该容器中加入 amolCO2、bmolH2、cmolCH3OH(g)和dmolH2O(g),且a、b、c、d均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同,试比较反应放出的能量:①___②(填“大于”“小于”或“等于”)
③下列措施中能使H2的转化率提高的是___(填字母).
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.相同条件下 再充入lmolCO2和4molH2
(3)甲醇是一种可再生能源具有广泛的开发和应用前景.某实验小组用一种以甲醇为原料的燃料电池作为电源,设计了一种电解法制取Fe(OH)2的实验装置如图3所示,通电后溶液中产生大量白色沉淀且较长时间不变色.
①该燃料电池的负极反应为___.
②下列说法中正确的是___(填序号)
A.电源中的负极附近 pH升高
B.电极B的发生氧化反应
C.A、B两端都必须用铁作电极
D.阴极发生的反应是2H++2e-=H2↑
E.电解的电解质溶液可以是CuSO4溶液
③若电池中甲醇的通入量为8g,且反应完全,则理论上最多能产生沉淀___g.
▼优质解答
答案和解析
(1)25℃,1.01×105Pa时,16g 液态甲醇物质的量为0.5mol,完全燃烧,当恢复到原状态时,放出363.3kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1;
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1.
(2)①在体积为lL的密闭容器中充入lmolCO2和4molH2,一定条件下发生反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),
初始浓度:1 4 0 0
变化浓度:0.75 2.25 0.75 0.75
平衡浓度:0.25 1.75 0.75 0.75
从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=
=0.075mol/(L•min);H2的转化率为
×100%=56.25%,故答案为:0.075mol/(L•min));56.25%;
②相同条件下达到平衡时,混合物中各组分的物质的量与(1)中平衡相同,说明两平衡为完全等效平衡,平衡时氨气的物质的量相同,由于(2)中起始含有cmol NH3,故(2)中反应生成的氨气比(1)少,(1)中参加反应的氮气的物质的量较(2)多,所以放出的热量(1)>(2).
故答案为:大于;
③A.反应是放热的,升高温度,平衡逆向移动,所以氢气的转化率减小,故错误;
B.将CH3OH(g)及时液化抽出,平衡正向移动,所以氢气的转化率增大,故正确;
C.选择高效催化剂,能加快反应速率,但是不会引起化学平衡的移动,转化率不变,故错误;
D.相同条件下 再充入lmolCO2和4molH2相当于对平衡加压,所以反应物的转化率增加,故正确,故选BD;
(3)①燃料电池是原电电池装置,通入燃料CH3OH是负极,发生氧化反应,电极反应为:CH3OH+8OH--6e-=CO32-+6H2O;故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
②A.电源中的负极附近发生反应:CH3OH+8OH--6e-=CO32-+6H2O,pH降低,故错误;
B.电极B和电源正极相连,是阳极,该电极上发生氧化反应,故正确;
C.电解法制取Fe(OH)2的阳极B材料是金属铁,该电极上金属铁失电子发生氧化反应,但是A电极不一定用金属铁,故错误;
D.阴极发生的反应是还原反应:2H++2e-=H2↑,该电极附近氢氧根离子浓度增加,产生氢氧化亚铁,故正确;
E.电解的电解质溶液不能是CuSO4溶液,这样的话在阴极上产生金属铜,发生的反应是金属铁置换铜的反应,不能得到氢氧化亚铁,故错误;
故选BD;
③若电池中甲醇的通入量为8g,且反应完全,根据负极反应:CH3OH+8OH--6e-=CO32-+6H2O,转移电子的物质的量是
×6=1.5mol,根据Fe~2e-~Fe(OH)2,则理论上最多能产生Fe(OH)2沉淀质量:
×90g/mol=67.5g,故答案为:67.5.
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)①在体积为lL的密闭容器中充入lmolCO2和4molH2,一定条件下发生反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),
初始浓度:1 4 0 0
变化浓度:0.75 2.25 0.75 0.75
平衡浓度:0.25 1.75 0.75 0.75
从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=
| 0.75mol/L |
| 10min |
| 2.25 |
| 4 |
②相同条件下达到平衡时,混合物中各组分的物质的量与(1)中平衡相同,说明两平衡为完全等效平衡,平衡时氨气的物质的量相同,由于(2)中起始含有cmol NH3,故(2)中反应生成的氨气比(1)少,(1)中参加反应的氮气的物质的量较(2)多,所以放出的热量(1)>(2).
故答案为:大于;
③A.反应是放热的,升高温度,平衡逆向移动,所以氢气的转化率减小,故错误;
B.将CH3OH(g)及时液化抽出,平衡正向移动,所以氢气的转化率增大,故正确;
C.选择高效催化剂,能加快反应速率,但是不会引起化学平衡的移动,转化率不变,故错误;
D.相同条件下 再充入lmolCO2和4molH2相当于对平衡加压,所以反应物的转化率增加,故正确,故选BD;
(3)①燃料电池是原电电池装置,通入燃料CH3OH是负极,发生氧化反应,电极反应为:CH3OH+8OH--6e-=CO32-+6H2O;故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
②A.电源中的负极附近发生反应:CH3OH+8OH--6e-=CO32-+6H2O,pH降低,故错误;
B.电极B和电源正极相连,是阳极,该电极上发生氧化反应,故正确;
C.电解法制取Fe(OH)2的阳极B材料是金属铁,该电极上金属铁失电子发生氧化反应,但是A电极不一定用金属铁,故错误;
D.阴极发生的反应是还原反应:2H++2e-=H2↑,该电极附近氢氧根离子浓度增加,产生氢氧化亚铁,故正确;
E.电解的电解质溶液不能是CuSO4溶液,这样的话在阴极上产生金属铜,发生的反应是金属铁置换铜的反应,不能得到氢氧化亚铁,故错误;
故选BD;
③若电池中甲醇的通入量为8g,且反应完全,根据负极反应:CH3OH+8OH--6e-=CO32-+6H2O,转移电子的物质的量是
| 8g |
| 32g/mol |
| 1.5mol |
| 2 |
看了实现节能减排和低碳经济的一项重...的网友还看了以下:
如果人类真的以超光速飞行将可能会出现怎么样的情况?例如我早上出去昨天晚上才回到家,那么这时我是否能 2020-04-05 …
若一个人的胸腺先天发育不良,可能造成的结果是()A.体内没有B细胞而仅仅有T细胞B.丧失一切免疫功 2020-06-15 …
求证近世代数问题:任何群G都不能是两个真子集的并证明:任何群G都不能是两个真子集的并 2020-06-16 …
“自由的精髓在于我们每个人都能参与决定我们的命运”这句话从政治意义上讲是要表明A.只有发扬民主才能 2020-06-29 …
1什么是革兰氏染色法?why2什么叫肽聚糖?它的化学结构如何?g+g-的肽聚糖结构有什么不同3s什 2020-07-16 …
图1为某池塘生态系统的能量金字塔简图,其中Ⅰ、Ⅱ、Ⅲ、Ⅳ分别代表不同的营养级,m1、m2代表不同的 2020-08-03 …
如图表示草场上某种草和某种羊的能量流动关系,对改图的描述,正确的是()A.a表示草光合作用固定的能量 2020-11-05 …
若一个人的胸腺先天发育不良,可能造成的结果是()A.体内没有B细胞而仅仅有T细胞B.丧失一切免疫功能 2020-11-25 …
重力的单位能在g,cm3中用吗重力单位是g=9.8N/kg在算木块浮力时木块体积重力太小,就想知道g 2020-12-05 …
翻译:倡议书我们能在这个群里相遇是难得的缘分,每个人都应该珍惜,翻译:倡议书我们能在这个群里相遇是难 2020-12-26 …