早教吧作业答案频道 -->化学-->
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s
题目详情
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=-76.0kJ•mol一1
①上述反应中每生成1mol Fe3O4,转移电子的物质的量为___mol.
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g)△H=+113.4kJ•mol一1,则反应:
3FeO(s)+H2O (g)=Fe3O4 (s)+H2 (g)的△H=___.
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2 (g)⇌C H4 (g)+2H2O(g)
向一容积为 2L的恒容密闭容器中充人一定量的CO2和H2,在 300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol•L-1,H2 0.8mol•L-1,CH40.8mol•L-1,H2O1.6mol•L-1.则300℃时上述反应的平衡常数K=___. 200℃时该反应的平衡常数K=64.8,则该反应的△H___ (填“>’’或“<”)0.
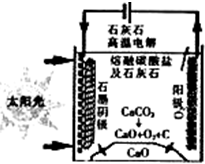
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
①上述生产过程的能量转化方式是___.
a、电能转化为化学能
b、太阳能转化为电能
c、太阳能转化为化学能
d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-则阳极的电极反应式为___.

(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=-76.0kJ•mol一1
①上述反应中每生成1mol Fe3O4,转移电子的物质的量为___mol.
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g)△H=+113.4kJ•mol一1,则反应:
3FeO(s)+H2O (g)=Fe3O4 (s)+H2 (g)的△H=___.
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2 (g)⇌C H4 (g)+2H2O(g)
向一容积为 2L的恒容密闭容器中充人一定量的CO2和H2,在 300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol•L-1,H2 0.8mol•L-1,CH40.8mol•L-1,H2O1.6mol•L-1.则300℃时上述反应的平衡常数K=___. 200℃时该反应的平衡常数K=64.8,则该反应的△H___ (填“>’’或“<”)0.
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
①上述生产过程的能量转化方式是___.
a、电能转化为化学能
b、太阳能转化为电能
c、太阳能转化为化学能
d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-则阳极的电极反应式为___.
▼优质解答
答案和解析
(1)①6FeO(s)+CO2(g)═2Fe3O4(s)+C(g)△H=-76.0KJ•mol-1该反应中每生成1molFe3O4,
反应的二氧化碳物质的量为0.5mol,1mol二氧化碳反应转移电子4mol,0.5mol二氧化碳反应转移电子2mol,所以转移电子的物质的量2mol;
故答案为:2;
②6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=-76.0kJ•mol-1
C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+113.4kJ•mol-1,
两热化学方程式相加除以2得:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)
△H=(-76.0kJ/mol+113.4kJ/mol)÷2=+18.7kJ/mol,
故答案为:+18.7kJ/mol;
(2)向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,
达到平衡时各物质的浓度分别为CO2 0.2mol•L-1,H2 0.8mol•L-1,CH4 0.8mol•L-1,H2O 1.6mol•L-1 ,起始充CO2和H2的物质的量浓度分别为x、y;
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
起始量 x y 0 0
变化量 0.8 3.2 0.8 1.6
平衡量 0.2 0.8 0.8 1.6
x=0.2mol+0.8mol=1mol,y=0.8mol+3.2mol=4mol;
平衡常数K=
=
=25,因300℃平衡常数K为25,200℃平衡常数K为64.8,温度升高,平衡常数减少,故正反应放热,
故答案为:25;<;
(3)①依据图示可知是太阳能和电能转化为化学能的变化过程,故答案为:ac;
②上述电解反应在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应是碳酸根离子失电子生成氧气的过程,电极反应为:2CO32--4e-═2CO2↑+O2↑,故答案为:2CO32--4e-═2CO2↑+O2↑.
反应的二氧化碳物质的量为0.5mol,1mol二氧化碳反应转移电子4mol,0.5mol二氧化碳反应转移电子2mol,所以转移电子的物质的量2mol;
故答案为:2;
②6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=-76.0kJ•mol-1
C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+113.4kJ•mol-1,
两热化学方程式相加除以2得:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)
△H=(-76.0kJ/mol+113.4kJ/mol)÷2=+18.7kJ/mol,
故答案为:+18.7kJ/mol;
(2)向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,
达到平衡时各物质的浓度分别为CO2 0.2mol•L-1,H2 0.8mol•L-1,CH4 0.8mol•L-1,H2O 1.6mol•L-1 ,起始充CO2和H2的物质的量浓度分别为x、y;
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
起始量 x y 0 0
变化量 0.8 3.2 0.8 1.6
平衡量 0.2 0.8 0.8 1.6
x=0.2mol+0.8mol=1mol,y=0.8mol+3.2mol=4mol;
平衡常数K=
| [CH4]•[H2O]2 |
| [CO2]•[H2]4 |
| 0.8×1.62 |
| 0.2×0.84 |
故答案为:25;<;
(3)①依据图示可知是太阳能和电能转化为化学能的变化过程,故答案为:ac;
②上述电解反应在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应是碳酸根离子失电子生成氧气的过程,电极反应为:2CO32--4e-═2CO2↑+O2↑,故答案为:2CO32--4e-═2CO2↑+O2↑.
看了 资源化利用二氧化碳不仅可减少...的网友还看了以下:
下列工业制备方法不正确的是()A.工业提取镁是将海水中的镁转化为氯化镁再电解得到单质镁B.工业提取 2020-05-14 …
下列过程中,发生化学变化的是()A.己烷提取大豆中的油脂B.工业上制氧气C.采用分馏的方法从石油中 2020-05-15 …
下列事实不能用勒夏特列原理解释的是()A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化 2020-06-26 …
下列事实不能用勒夏特列原理解释的是()A.工业合成SO3的过程中使用过量的氧气,以提高二氧化硫的转 2020-06-26 …
铝在自然界中主要以铝矾土(Al2O3.xH2O)氧化物的形式存在.镓(Ga)常以极少量分散于铝矿中. 2020-11-02 …
下列关于氧气用途的叙述,错误的是()A.用于钢铁工业,提高钢铁的质量和产量B.氧炔焰用来焊接或切割金 2020-12-22 …
下列关于氧气用途的叙述,错误的是()A.用于钢铁工业,提高钢铁的质量和产量B.氧炔焰用来焊接或切割金 2020-12-22 …
下列关于氧气用途的叙述,错误的是()A.用于钢铁工业,提高钢铁的质量和产量B.氧炔焰用来焊接或切割金 2020-12-22 …
工业生产中,可用盐酸清洗铁材表面的致密氧化层.为了提高酸洗液的浓度或温度以加快反应,可在酸洗液中加入 2021-01-13 …
下列有关工业生产的叙述正确的是()A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、 2021-02-09 …