早教吧作业答案频道 -->化学-->
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.(1)写出钢铁表面吸附的水膜酸性很弱或呈中性时的正极材料是,其电
题目详情
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
(1)写出钢铁表面吸附的水膜酸性很弱或呈中性时的正极材料是___,其电极反应式为___,列举几种常见的金属防腐蚀的电化学方法___(写出两种).
(2)钢铁的表面发蓝、发黑处理也是常用的防腐方法.
下列反应是主要反应之一.请配平方程式:口 Na2FeO2+口 NaNO2+口=口 NaFeO2+口 NH3↑+口 NaOH
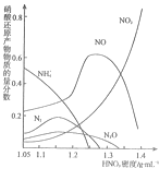
(3)钢铁的“钝化”处理也能达到防腐目的,经冷、浓HNO3处理后,其表面有一层致密氧化物保护膜,但是加热或在HNO3中就不能“钝化”.不同浓度的 HNO3 与铁反应的还原产物很复杂,其分布曲线如图.
①如图可知,密度为 1.05g•mL-1的硝酸与铁反应时,其最多的还原产物是___;密度大于1.35g•mL-1的硝酸与铁反应时,其还原产物主要是 NO2;分析HNO3 与铁反应的规律是:___.
②m g 铁与含 n g HNO3的硝酸溶液恰好完全反应,若硝酸的还原产物只有 NO,则 m 的取值可能是___(填字母编号)
A.
n B.
n C.
n D.
n E.
n
③工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是:___.

(1)写出钢铁表面吸附的水膜酸性很弱或呈中性时的正极材料是___,其电极反应式为___,列举几种常见的金属防腐蚀的电化学方法___(写出两种).
(2)钢铁的表面发蓝、发黑处理也是常用的防腐方法.
下列反应是主要反应之一.请配平方程式:口 Na2FeO2+口 NaNO2+口=口 NaFeO2+口 NH3↑+口 NaOH
(3)钢铁的“钝化”处理也能达到防腐目的,经冷、浓HNO3处理后,其表面有一层致密氧化物保护膜,但是加热或在HNO3中就不能“钝化”.不同浓度的 HNO3 与铁反应的还原产物很复杂,其分布曲线如图.
①如图可知,密度为 1.05g•mL-1的硝酸与铁反应时,其最多的还原产物是___;密度大于1.35g•mL-1的硝酸与铁反应时,其还原产物主要是 NO2;分析HNO3 与铁反应的规律是:___.
②m g 铁与含 n g HNO3的硝酸溶液恰好完全反应,若硝酸的还原产物只有 NO,则 m 的取值可能是___(填字母编号)
A.
| 1 |
| 5 |
| 2 |
| 9 |
| 1 |
| 4 |
| 1 |
| 3 |
| 1 |
| 2 |
③工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是:___.
▼优质解答
答案和解析
(1)钢铁锈蚀正极为C,在吸附的水膜酸性很弱或呈中性时,电极反应为2H2O+O2+4e-=4OH-,金属防腐蚀的电化学方法一是利用原电池原理的牺牲阳极的阴极保护法,另一个为利用电解池原理的外加电源的阴极保护法;故答案为:C;2H2O+O2+4e-=4OH-;牺牲阳极的阴极保护法、外加电源的阴极保护法;
(2)分析化合价变化,铁元素化合价从+2价变化为+3价,氮元素化合价从+3价变化为-3价,
Na2FeO2~NaFeO2~e-,NaNO2~NH3~6e-
依据电子守恒Na2FeO2的配平系数为6,NaFeO2的配平系数为6,NaNO2和NH3的配平系数为1,
依据原子守恒配平NaOH,配平系数为7,根据原子守恒,缺项为H2O,H2O的配平系数为5,
化学方程式为:6Na2FeO2+NaNO2+5H2O═6NaFeO2+NH3↑+7NaOH,
故答案为:6;1;5H2O;6;1;7;
(3)①根据图象知,该条件下,硝酸主要被还原为NH4+,硝酸的浓度越大,其还原产物中氮元素化合价越高,
故答案为:NH4+;硝酸的浓度越大,其还原产物中氮元素化合价越高;
②生成硝酸铁时,溶解Fe的质量最小,根据电子转移守恒n(NO)=
×
=
mol,
根据氮原子守恒可知n(HNO3)=n(NO)+3n[Fe(NO3)3],即
mol+
mol×3=
,整理得整理得m=
n,
生成硝酸亚铁时溶解Fe的质量最大,根据电子转移守恒n(NO)=
×
=
mol,
根据氮原子守恒可知n(HNO3)=n(NO)+2n[Fe(NO3)2],
则
mol+2×
mol=
,整理得m=
n
故m的取值范围为:
n≤m≤
n,B、C、D都符合,
故答案为:B、C、D;
③工业上一般不用冷浓硝酸进行铁表面处理,浓硝酸具有易挥发,见光分解,生成产物污染空气等性质,
故答案为:硝酸易挥发,不稳定,见光易分解,故不易操作,生成物对环境污染严重;
(2)分析化合价变化,铁元素化合价从+2价变化为+3价,氮元素化合价从+3价变化为-3价,
Na2FeO2~NaFeO2~e-,NaNO2~NH3~6e-
依据电子守恒Na2FeO2的配平系数为6,NaFeO2的配平系数为6,NaNO2和NH3的配平系数为1,
依据原子守恒配平NaOH,配平系数为7,根据原子守恒,缺项为H2O,H2O的配平系数为5,
化学方程式为:6Na2FeO2+NaNO2+5H2O═6NaFeO2+NH3↑+7NaOH,
故答案为:6;1;5H2O;6;1;7;
(3)①根据图象知,该条件下,硝酸主要被还原为NH4+,硝酸的浓度越大,其还原产物中氮元素化合价越高,
故答案为:NH4+;硝酸的浓度越大,其还原产物中氮元素化合价越高;
②生成硝酸铁时,溶解Fe的质量最小,根据电子转移守恒n(NO)=
| mg |
| 56g/mol |
| 3 |
| 5-2 |
| m |
| 56 |
根据氮原子守恒可知n(HNO3)=n(NO)+3n[Fe(NO3)3],即
| m |
| 56 |
| m |
| 56 |
| ng |
| 63g/mol |
| 2 |
| 9 |
生成硝酸亚铁时溶解Fe的质量最大,根据电子转移守恒n(NO)=
| mg |
| 56g/mol |
| 2 |
| 5-2 |
| m |
| 84 |
根据氮原子守恒可知n(HNO3)=n(NO)+2n[Fe(NO3)2],
则
| m |
| 84 |
| m |
| 56 |
| ng |
| 63g/mol |
| 1 |
| 3 |
故m的取值范围为:
| 2 |
| 9 |
| 1 |
| 3 |
故答案为:B、C、D;
③工业上一般不用冷浓硝酸进行铁表面处理,浓硝酸具有易挥发,见光分解,生成产物污染空气等性质,
故答案为:硝酸易挥发,不稳定,见光易分解,故不易操作,生成物对环境污染严重;
看了金属腐蚀造成很大的经济损失,甚...的网友还看了以下:
水葫芦导致水生动物胡绝的关系叫什么水葫芦是水生植物不能进行光合作用而枯萎,植物的枯萎使水生动物缺少 2020-04-08 …
“北京,下土了”--2006年4月.北京遭遇多年来最严重的沙尘暴袭击.专家指出,沙尘暴在带来严重危 2020-05-13 …
中日《马关条约》是继中英《南京条约》签订以来,对中国造成最严重危害的不平等条约之一。前者内容与后者 2020-05-16 …
突发公共卫生事件是指突然发生,造成或者可能造成社会公众健康严重损害的重大A.食物中毒和职业中 2020-05-17 …
突发公共卫生事件是指突然发生,造成或者可能造成社会公众健康严重损害的重大A.公众安全事件###SX 2020-05-17 …
突发事件是指事先没有觉察而突然发生,对涉及治安秩序造成严重危害的突然性、紧急性事件。人民警察 2020-05-19 …
阅读材料,说说你的发现材料一:在北美阿拉斯加的茫茫荒原上,生长着一种老鼠,以植被为生,繁殖力极强. 2020-06-23 …
(2006•甘孜州)“北京,下土了”.2006年4月,北京遭遇多年来最严重的沙尘暴袭击.专家指出, 2020-06-23 …
针对近年来全国酒后驾驶违法行为日益增多,对社会造成严重危害的现象,2011年2月全国人大常委会表决 2020-07-11 …
党和政府对“法轮功”的处理历来严格掌握政策界限,对大部分“法轮功”练习者坚持团结、教育、转化、挽救 2020-07-12 …