早教吧作业答案频道 -->化学-->
天然碱的主要成分是碳酸钠和碳酸氢钠.以天然碱为原料制备氢氧化钠的工艺流程可简单表示如图1所示:(1)碳酸钠俗称,其主要用途有(写出一种即可).(2)实验室进行溶解操作
题目详情
天然碱的主要成分是碳酸钠和碳酸氢钠.以天然碱为原料制备氢氧化钠的工艺流程可简单表示如图1所示:
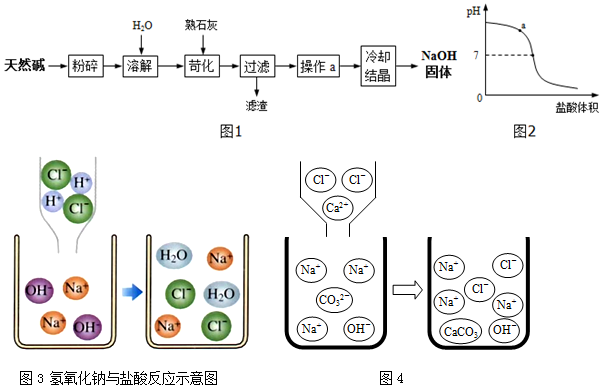
(1)碳酸钠俗称___,其主要用途有___(写出一种即可).
(2)实验室进行溶解操作时,使用玻璃棒的主要目的是___;操作a的名称是___.
(3)“苛化”时主要发生两个化学反应,其一为:NaHCO3+Ca(OH)2═NaOH+CaCO3↓+H2O;另一化学反应方程式为:___,该反应属于___(填基本反应类型).
(4)某化学兴趣小组同学为了测定产品NaOH固体(含少量碳酸钠)中NaOH的质量分数,进行了如下实验:
Ⅰ.称取NaOH固体样品2.15g,加适量水使之完全溶解.
Ⅱ.向上述溶液中滴加CaCl2溶液至不再产生白色沉淀,过滤.
Ⅲ.向滤液中加入质量分数为10.0%的盐酸溶液,所加盐酸溶液的体积与溶液的pH关系如图2所示.
回答下列问题:
①图中a点溶液中所含的阴离子有___(填离子符号).
②如图3是氢氧化钠与盐酸反应示意图,该反应的本质可以表示为OH-+H+=H2O.步骤Ⅱ中反应的示意图如图4,则该反应的本质可以表示为:___.
③已知氯化钠、氯化钙溶液均呈中性.当所加入的盐酸溶液质量为18.25g时,溶液的pH=7,则NaOH固体样品中NaOH的质量分数是___.(写出计算过程,否则不得分.结果以百分比表示,保留3位有效数字)

(1)碳酸钠俗称___,其主要用途有___(写出一种即可).
(2)实验室进行溶解操作时,使用玻璃棒的主要目的是___;操作a的名称是___.
(3)“苛化”时主要发生两个化学反应,其一为:NaHCO3+Ca(OH)2═NaOH+CaCO3↓+H2O;另一化学反应方程式为:___,该反应属于___(填基本反应类型).
(4)某化学兴趣小组同学为了测定产品NaOH固体(含少量碳酸钠)中NaOH的质量分数,进行了如下实验:
Ⅰ.称取NaOH固体样品2.15g,加适量水使之完全溶解.
Ⅱ.向上述溶液中滴加CaCl2溶液至不再产生白色沉淀,过滤.
Ⅲ.向滤液中加入质量分数为10.0%的盐酸溶液,所加盐酸溶液的体积与溶液的pH关系如图2所示.
回答下列问题:
①图中a点溶液中所含的阴离子有___(填离子符号).
②如图3是氢氧化钠与盐酸反应示意图,该反应的本质可以表示为OH-+H+=H2O.步骤Ⅱ中反应的示意图如图4,则该反应的本质可以表示为:___.
③已知氯化钠、氯化钙溶液均呈中性.当所加入的盐酸溶液质量为18.25g时,溶液的pH=7,则NaOH固体样品中NaOH的质量分数是___.(写出计算过程,否则不得分.结果以百分比表示,保留3位有效数字)
▼优质解答
答案和解析
(1)碳酸钠俗称 纯碱,其主要用途有 制造玻璃、造纸、纺织和洗涤剂的生产等(写出一种即可).
(2)实验室进行溶解操作时,使用玻璃棒的主要目的是 加速溶解;操作a后面紧跟降温结晶,所以该过程应该是温度升高的浓缩过程,所以是 蒸发.
(3)“苛化”时主要发生两个化学反应,其一为:NaHCO3+Ca(OH)2═NaOH+CaCO3↓+H2O;由于“天然碱的主要成分是碳酸钠和碳酸氢钠“,第一个反应是与碳酸氢钠有关,则第二个反应与碳酸钠有关,碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙,对应的化学方程式为:Na2CO3+Ca(OH)2═2NaOH+CaCO3↓,该是两种化合物相互交换成分生成两种新的化合物,为复分解反应.
(4)某化学兴趣小组同学为了测定产品NaOH固体(含少量碳酸钠)中NaOH的质量分数,进行了如下实验:
Ⅰ.称取NaOH固体样品2.15g,加适量水使之完全溶解.
Ⅱ.向上述溶液中滴加CaCl2溶液至不再产生白色沉淀,过滤.
Ⅲ.向滤液中加入质量分数为10.0%的盐酸溶液,所加盐酸溶液的体积与溶液的pH关系如图2所示.
这个首先要清楚,先加入氯化钙使碳酸钠沉淀,之后用盐酸和氢氧化钠反应,所以后面给出的pH与盐酸的体积关系与碳酸钠无关,这一点对于分析问题①
尤为重要.
①图中表示的是向氢氧化钠和氯化钠的混合物溶液中加入盐酸,a点是溶液pH大于7,说明氢氧化钠还有剩余,所以此时的溶质有氢氧化钠和氯化钠,所以溶液中所含的阴离子有 Cl-和OH-.
②如图3是氢氧化钠与盐酸反应示意图,该反应的本质可以表示为OH-+H+=H2O.所谓本质结合图可以看出为实际过程中发生改变的微粒,所以步骤Ⅱ中反应的示意图如图4,前后减少的是钙离子和碳酸根离子,多的微粒是碳酸钙分子,所以该反应的本质可以表示为:Ca2++CO32-=CaCO3↓.
③已知氯化钠、氯化钙溶液均呈中性.当所加入的盐酸溶液质量为18.25g时,溶液的pH=7,由于盐酸的质量分数为10.0%.
设氢氧化钠的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 18.25g×10%
=
x=2g
则NaOH固体样品中NaOH的质量分数为
×100%≈93.0%
故答案为:
(1)纯碱; 制造玻璃、造纸、纺织和洗涤剂的生产等;
(2)加速溶解; 蒸发.
(3)Na2CO3+Ca(OH)2═2NaOH+CaCO3↓; 复分解反应;
(4)
①Cl-和 OH-;
②Ca2++CO32-=CaCO3↓.
③93.0%
(1)碳酸钠俗称 纯碱,其主要用途有 制造玻璃、造纸、纺织和洗涤剂的生产等(写出一种即可).
(2)实验室进行溶解操作时,使用玻璃棒的主要目的是 加速溶解;操作a后面紧跟降温结晶,所以该过程应该是温度升高的浓缩过程,所以是 蒸发.
(3)“苛化”时主要发生两个化学反应,其一为:NaHCO3+Ca(OH)2═NaOH+CaCO3↓+H2O;由于“天然碱的主要成分是碳酸钠和碳酸氢钠“,第一个反应是与碳酸氢钠有关,则第二个反应与碳酸钠有关,碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙,对应的化学方程式为:Na2CO3+Ca(OH)2═2NaOH+CaCO3↓,该是两种化合物相互交换成分生成两种新的化合物,为复分解反应.
(4)某化学兴趣小组同学为了测定产品NaOH固体(含少量碳酸钠)中NaOH的质量分数,进行了如下实验:
Ⅰ.称取NaOH固体样品2.15g,加适量水使之完全溶解.
Ⅱ.向上述溶液中滴加CaCl2溶液至不再产生白色沉淀,过滤.
Ⅲ.向滤液中加入质量分数为10.0%的盐酸溶液,所加盐酸溶液的体积与溶液的pH关系如图2所示.
这个首先要清楚,先加入氯化钙使碳酸钠沉淀,之后用盐酸和氢氧化钠反应,所以后面给出的pH与盐酸的体积关系与碳酸钠无关,这一点对于分析问题①
尤为重要.
①图中表示的是向氢氧化钠和氯化钠的混合物溶液中加入盐酸,a点是溶液pH大于7,说明氢氧化钠还有剩余,所以此时的溶质有氢氧化钠和氯化钠,所以溶液中所含的阴离子有 Cl-和OH-.
②如图3是氢氧化钠与盐酸反应示意图,该反应的本质可以表示为OH-+H+=H2O.所谓本质结合图可以看出为实际过程中发生改变的微粒,所以步骤Ⅱ中反应的示意图如图4,前后减少的是钙离子和碳酸根离子,多的微粒是碳酸钙分子,所以该反应的本质可以表示为:Ca2++CO32-=CaCO3↓.
③已知氯化钠、氯化钙溶液均呈中性.当所加入的盐酸溶液质量为18.25g时,溶液的pH=7,由于盐酸的质量分数为10.0%.
设氢氧化钠的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 18.25g×10%
| 40 |
| 36.5 |
| x |
| 18.25g×10% |
x=2g
则NaOH固体样品中NaOH的质量分数为
| 2g |
| 2.15g |
故答案为:
(1)纯碱; 制造玻璃、造纸、纺织和洗涤剂的生产等;
(2)加速溶解; 蒸发.
(3)Na2CO3+Ca(OH)2═2NaOH+CaCO3↓; 复分解反应;
(4)
①Cl-和 OH-;
②Ca2++CO32-=CaCO3↓.
③93.0%
看了天然碱的主要成分是碳酸钠和碳酸...的网友还看了以下:
(2010•内江)用“伏安法”测量阻值约为7Ω的电阻的阻值,现备有的实验器材有:A.待测电阻Rx; 2020-06-30 …
《铁路运输设备》第一次大作业一、填空题(每空4分,共60分)1.铁路线路是由、和组成的一个整体工程 2020-07-11 …
小军想设计一个模拟交通路口红绿灯工作的实验电路,要求:红灯亮时,黄灯和绿灯都不亮;当红灯灭时,黄灯和 2020-11-11 …
实验小组的同学们想探究:气体的密度大小随温度的变化关系.实验桌上备有的实验器材有:大小适中的橡皮膜1 2020-12-03 …
为了减小实验误差,需进一步测其电阻,除待测金属丝外,实验室还备有的实验器材如下:A.电压表V1(量程 2020-12-05 …
下列名言能体现量变与质变辩证关系的有①和实生物,同则不继②寄言持重者,微物莫全侵③世异则事异,事异则 2020-12-18 …
下列名言能体现量变与质变辩证关系的有①和实生物,同则不继②寄言持重者,微物莫全侵③世异则事异,事异则 2020-12-18 …
为了测量一金属丝的电阻(约5Ω),实验室还备有的实验器材如下:A.电压表V1(量程3V,内阻约为15 2020-12-20 …
为了测量一精密金属丝的电阻率:(1)先用多用电表初测其电阻约为6Ω,然后用螺旋测微器测其直径为mm, 2020-12-20 …
为了测量一精密金属丝的电阻率:(1)先用多用电表初测其电阻约为6Ω,然后用螺旋测微器测其直径为mm, 2020-12-20 …