早教吧作业答案频道 -->化学-->
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的
题目详情
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过___、___后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
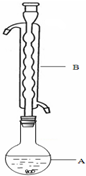
(1)仪器B的名称是___.其作用是___.加入的硫粉用乙醇润湿的目的是___.
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是___.如果滤液中该杂质的含量不很低,其检测的方法是:___.
(3)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用___(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
则所得产品的纯度为___,你认为影响纯度的主要原因是(不考虑操作引起误差)___.
现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过___、___后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.

(1)仪器B的名称是___.其作用是___.加入的硫粉用乙醇润湿的目的是___.
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是___.如果滤液中该杂质的含量不很低,其检测的方法是:___.
(3)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用___(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
▼优质解答
答案和解析
②通过蒸发浓缩,冷却结晶,过滤洗涤,干燥等步骤得到溶液中的溶质固体,
故答案为:蒸发浓缩;冷却结晶;
(1)根据装置图可知,仪器B为冷凝管或冷凝器,结烧瓶中的液体进行冷凝回流,硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润是使硫粉易于分散到溶液中,有利于硫粉和Na2SO3溶液充分接触,加快反应速率,
故答案为:冷凝管或冷凝器;冷凝回流;增加反应物接触面积,提高反应速率;
(2)S2O32‾具有还原性,能够被氧气氧化成硫酸根离子,滤液中除Na2S2O3和可能未反应完全的Na2SO3外,存在被氧化产物硫酸钠,所以可能存在的杂质是硫酸钠,其检测的方法依据硫酸根离子检验:取出少许溶液,加盐酸至酸性后,区上层清液或过滤除去S,再加BaCl2溶液.则加入的盐酸发生两个反应的化学方程式为:Na2SO3+2HCl═SO2↑+H2O+2NaCl,Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl,取出少许溶液,加稀盐酸至酸性,静置后,取上层清液,再加BaCl2溶液,若出现浑浊则含Na2SO4,反之不含,
故答案为:Na2SO4;取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出S,再往滤液中加BaCl2溶液,如有白色沉淀即可证明含有Na2SO4,反之不含;
(3)碘水有氧化性,能腐蚀橡胶管,所以碘水应放在酸式滴定管中进行滴定,根据题中表中的数据可知,第二次数据偏差较大,所以取一、三两次实验的数据,所以用去的碘水的体积为
mL=30.8mL,碘的物质的量为:0.0500mol•L-l×0.0308L=0.00154mol,
2S2O32-+I2═S4O62-+2I-,
2 1
x 0.00154mol
解x=0.00308mol,故Na2S2O3•5H2O的物质的量为0.00308mol,质量为:0.00308×248g/mol=0.7638g,
则称取7.40g产品,配制成250mL溶液中,Na2S2O3•5H2O的质量为=0.7638g×
=7.638g
故产品的纯度为:
×100%=103.2%,
碘单质有强的氧化性,Na2SO3具有还原性,Na2SO3会和I2发生反应,从而影响纯度,
故答案为:酸式;103.2%;含有的Na2SO3也会和I2发生反应,从而影响纯度.
故答案为:蒸发浓缩;冷却结晶;
(1)根据装置图可知,仪器B为冷凝管或冷凝器,结烧瓶中的液体进行冷凝回流,硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润是使硫粉易于分散到溶液中,有利于硫粉和Na2SO3溶液充分接触,加快反应速率,
故答案为:冷凝管或冷凝器;冷凝回流;增加反应物接触面积,提高反应速率;
(2)S2O32‾具有还原性,能够被氧气氧化成硫酸根离子,滤液中除Na2S2O3和可能未反应完全的Na2SO3外,存在被氧化产物硫酸钠,所以可能存在的杂质是硫酸钠,其检测的方法依据硫酸根离子检验:取出少许溶液,加盐酸至酸性后,区上层清液或过滤除去S,再加BaCl2溶液.则加入的盐酸发生两个反应的化学方程式为:Na2SO3+2HCl═SO2↑+H2O+2NaCl,Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl,取出少许溶液,加稀盐酸至酸性,静置后,取上层清液,再加BaCl2溶液,若出现浑浊则含Na2SO4,反之不含,
故答案为:Na2SO4;取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出S,再往滤液中加BaCl2溶液,如有白色沉淀即可证明含有Na2SO4,反之不含;
(3)碘水有氧化性,能腐蚀橡胶管,所以碘水应放在酸式滴定管中进行滴定,根据题中表中的数据可知,第二次数据偏差较大,所以取一、三两次实验的数据,所以用去的碘水的体积为
| 30.78+30.82 |
| 2 |
2S2O32-+I2═S4O62-+2I-,
2 1
x 0.00154mol
解x=0.00308mol,故Na2S2O3•5H2O的物质的量为0.00308mol,质量为:0.00308×248g/mol=0.7638g,
则称取7.40g产品,配制成250mL溶液中,Na2S2O3•5H2O的质量为=0.7638g×
| 250 |
| 25 |
故产品的纯度为:
| 7.638g |
| 7.40g |
碘单质有强的氧化性,Na2SO3具有还原性,Na2SO3会和I2发生反应,从而影响纯度,
故答案为:酸式;103.2%;含有的Na2SO3也会和I2发生反应,从而影响纯度.
看了Na2S2O3俗称大苏打(海波...的网友还看了以下:
在等差数列an中,有下述结论:若a1+a2+……+a50=s,a(n-49)+a(n-48)+…… 2020-05-14 …
I can't say which wine is beat—it's a (n) of pers 2020-05-17 …
● 程序语言的大多数语法现象可用上下文无关文法描述。对于一个上下文无关文法G=(N,T,P,S),其 2020-05-26 …
程序语言的大多数语法现象可用上下文无关文法描述。对于一个上下文无关文法 G=(N,T,P,S),其中 2020-05-26 …
程序语言的大多数语法现象可用上下文无关文法描述。对于一个上下文无关文法G=(N,T,P,S),其中N 2020-05-26 …
有it’s+a+adj+n+to+V这个句式啊,这个句式的翻译 2020-07-09 …
已知a[n]为一个整形数组,试写出实现下列运算的递归算法.(1):求数组a中的最大整数.(2):求 2020-07-23 …
将数组a中n个整数按相反顺序存放中的j=n-1-i怎么解释啊看不懂 2020-08-03 …
求通项的问题A=bAn+2^n(b是常数,A中n+1是底数)An的通项应该怎么求呢 2020-12-14 …
化合物A、大是中学常见的物质,其阴阳离子可从下表中选择阳离子K+&n大s多;&n大s多;Na+&n大 2021-01-18 …