化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s)
化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的 SO 2 是大气中 SO 2 的主要来源。
(1) 将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为 C(s) + H 2 O(g) CO(g) + H 2 (g) ,该反应的化学平衡常数表达式为 K = ________ 。
若反应的逆反应速率与时间的关系如图所示:
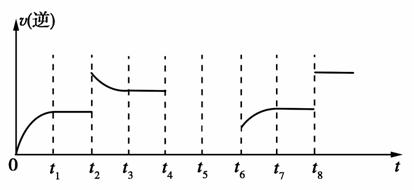
① 可见反应在 t 1 、 t 3 、 t 7 ,时都达到了平衡,而 t 2 、 t 8 时都改变了一种条件,试判断 t 2 时改变的是什么条件: t 2 时 ________________ 。
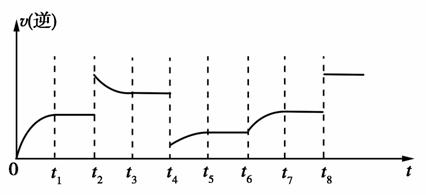
② 若 t 4 时降压, t 6 时增大反应物的浓度,请在图中画出 t 4 ~ t 6 时逆反应速率与时间的关系线。
(2) 碘循环工艺不仅能吸收 SO 2 降低环境污染,同时又能制得氢气,具体流程如下:
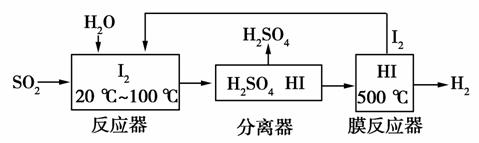
① 用离子方程式表示反应器中发生的反应: ________________ 。
② 用化学平衡移动的原理分析,在 HI 分解反应中使用膜反应器分离出 H 2 的目的是 ________________ 。
解析: (1) 固体不写入平衡常数表达式中。 ① 观察图像可知 t 2 时逆反应速率突然增大,并且平衡逆向移动,所以改变的条件可能是增大压强或增大生成物浓度。该反应是吸热反应,升高温度平衡正向移动,而加入催化剂对平衡移动无影响,所以不可能是升高温度或使用催化剂。 ② 若 t 4 时降压,正、逆反应速率突然减小,平衡正向移动,正反应速率大于逆反应速率,在趋于平衡的过程中逆反应速率逐渐增大,平衡时与 t 6 时 v ( 逆 ) 相等。 (2) ① 反应器中发生反应的化学方程式为 I 2 + SO 2 + 2H 2 O == =H 2 SO 4 + 2HI ,改写成离子方程式即可。 ② 该循环工艺的目的之一是制备氢气,而 HI 分解生成 H 2 与 I 2 (g) 的反应是可逆反应,为了增大 H 2 的产率,使平衡正向移动,需要不断地分离出氢气。
答案 : (1) c (CO)· c (H 2 )/ c (H 2 O)(2 分 )
① 增大压强或增大生成物浓度 (2 分 )
②
(2) ① SO 2 + I 2 + 2H 2 O == =4H + + SO ![]() + 2I - (2 分 )
+ 2I - (2 分 )
② 降低生成物的浓度,使平衡正向移动 (2 分 )
甲乙2堆煤共重1680千克甲堆煤用去3/4乙堆煤用去2/3剩下的煤的重量相等甲乙甲乙2堆煤共重168 2020-03-31 …
甲乙2堆煤共重1680千克甲堆煤用去3/4乙堆煤用去2/3剩下的煤的重量相等甲乙两甲乙2堆煤共重16 2020-03-31 …
甲乙2堆煤共重1680千克甲堆煤用去3/4乙堆煤用去2/3剩下的煤的重量相等甲乙甲乙2堆煤共重168 2020-03-31 …
甲乙2堆煤共重1680千克甲堆煤用去3/4乙堆煤用去2/3剩下的煤的重量相等甲乙两甲乙2堆煤共重16 2020-03-31 …
一堆煤,用去总数的40%后,又运进24吨,这时的煤是原来的三分之一,这堆煤原有多少吨?最好用方程解 2020-04-27 …
煤是来源于古代的... 2020-05-16 …
某煤场有一堆煤运出12\11,又运来11吨,这是厂里煤原来存煤的比是1:8,原来存煤多少? 2020-06-04 …
桦尺蠖的体色受一对等位基因控制,黑色(S)对浅色(s)是显性,某地区为森林时,尺蠖种群的基因频率和 2020-06-29 …
一辆煤车以速率v=3从煤斗下经过,煤的下落速度为u=500kg/s,要是车厢速率不变.牵引力为多少 2020-07-06 …
下列说法正确的是()A.把煤加强热使之分解的过程叫煤的干馏B.煤的气化属于化学变化C.煤是工业上获得 2020-11-16 …