早教吧作业答案频道 -->化学-->
镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取.从海水中先将海水淡化获得淡水和浓海水,浓海水的主要成分如下:离子Na+Mg2+Cl-SO42-浓度/(g•L-1)63.7
题目详情
镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取.从海水中先将海水淡化获得淡水和浓海水,浓海水的主要成分如下:
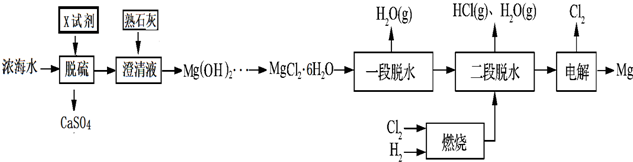
再利用浓海水提镁的一段工艺流程如下图:
请回答下列问题
(1)浓海水主要含有的四种离子中物质的量浓度最小的是___.在上述流程中,可以循环使用的物质是___.
(2)在该工艺过程中,X试剂的化学式为___.
(3)“一段脱水”目的是制备MgCl2•2H2O;“二段脱水”的目的是制备电解原料.若将MgCl2•6H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为___.
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为___g.
(5)以LiCl-KCl共熔盐为电解质的Mg-V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl MgCl2+V2O4•Li2O 该电池的正极反应式为___.
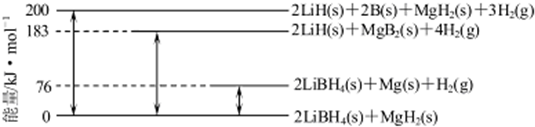
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则:
Mg(s)+2B(s) MgB2(s)△H=___.
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |

请回答下列问题
(1)浓海水主要含有的四种离子中物质的量浓度最小的是___.在上述流程中,可以循环使用的物质是___.
(2)在该工艺过程中,X试剂的化学式为___.
(3)“一段脱水”目的是制备MgCl2•2H2O;“二段脱水”的目的是制备电解原料.若将MgCl2•6H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为___.
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为___g.
(5)以LiCl-KCl共熔盐为电解质的Mg-V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl MgCl2+V2O4•Li2O 该电池的正极反应式为___.
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则:
Mg(s)+2B(s) MgB2(s)△H=___.

▼优质解答
答案和解析
浓海水加入氯化钙,可生成硫酸钙,一达到脱硫的目的,加入熟石灰,可生成氢氧化镁,进而生成MgCl2•6H2O,一段脱水生成MgCl2•2H2O,在通入HCl的氛围中加入氯化镁溶液得到氯化镁,电解可得到镁和氯气,
(1)由表中数据c(Na+)=
=2.77mol/L,c(Mg2+)=
=1.2mol/L,c(Cl-)=
=4.07mol/L,c(SO42-)=
=0.48mol/L,故SO42-的物质的量浓度最小,上述流程中氯气和与氢气反应生成氯化氢,氯化氢可与氢氧化镁反应制备氯化镁,则可循环的是Cl2、HCl,
故答案为:SO42-;Cl2、HCl;
(2)X为氯化钙,可生成硫酸钙,一达到脱硫的目的,
故答案为:CaCl2;
(3)由题意知Mg(OH)Cl与阴极产生的Mg反应,产生MgO,反应的化学方程式为2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑,
故答案为:2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑;
(4)由题给数据可知1m3浓海水含有m(Mg2+)=1000L×28.8g/L,n(Mg2+)=
mol,则生成Mg(OH)2的物质的量为
mol×80%,经二段脱水生成MgCl2的物质的量为
×80%×90%,质量为
mol×80%×90%×95g/mol=82080g,
故答案为:82080;
(5)正极发生还原反应,V2O5被还原生成V2O4•Li2O,电极方程式为V2O5+2Li++2e-=V2O4•Li2O,
故答案为:V2O5+2Li++2e-=V2O4•Li2O;
(6)由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1④
所以-④-②得:Mg(s)+2B(s)═MgB2(s)△H=-(17+76)kJ•mol-1=-93kJ•mol-1,
故答案为:-93kJ•mol-1.
(1)由表中数据c(Na+)=
| 63.7g/L |
| 23g/mol |
| 28.8g/L |
| 24g/mol |
| 144.6g/L |
| 35.5g/mol |
| 46.4g/L |
| 96g/mol |
故答案为:SO42-;Cl2、HCl;
(2)X为氯化钙,可生成硫酸钙,一达到脱硫的目的,
故答案为:CaCl2;
(3)由题意知Mg(OH)Cl与阴极产生的Mg反应,产生MgO,反应的化学方程式为2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑,
故答案为:2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑;
(4)由题给数据可知1m3浓海水含有m(Mg2+)=1000L×28.8g/L,n(Mg2+)=
| 1000×28.8 |
| 24 |
| 1000×28.8 |
| 24 |
| 1000×28.8 |
| 24 |
| 1000×28.8 |
| 24 |
故答案为:82080;
(5)正极发生还原反应,V2O5被还原生成V2O4•Li2O,电极方程式为V2O5+2Li++2e-=V2O4•Li2O,
故答案为:V2O5+2Li++2e-=V2O4•Li2O;
(6)由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1④
所以-④-②得:Mg(s)+2B(s)═MgB2(s)△H=-(17+76)kJ•mol-1=-93kJ•mol-1,
故答案为:-93kJ•mol-1.
看了镁及其化合物用途非常广泛,目前...的网友还看了以下:
我国海岸线长,海洋专属经济区复原辽阔,海洋资源丰富,开发的前景十分远大.Ⅰ.我国海盐年产量3千多万 2020-05-16 …
目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为民用燃料,管道 2020-06-29 …
(6分)目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为民用燃 2020-07-03 …
目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为民用燃料。管道 2020-07-29 …
以前上海大部分城市居民所使用的燃料主要是管道煤气,随着“西气东输”进入上海,上海居民都将用上天然气 2020-07-29 …
我国海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发前景十分远大.(1)我国海盐年 2020-10-30 …
我国海岸线长,海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大.Ⅰ.我国海盐年产量3千多万吨 2020-11-27 …
我国海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发前景十分远大。我国海盐年产量3 2020-11-27 …
我国海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大.(1)我国海盐 2020-11-27 …
海洋中蕴含着丰富的资源,海洋资源开发前景十分广阔.(1)海水晒盐.2015年我国海盐年产量高达579 2020-12-02 …