(15分)硫代硫酸钠是一种重要的化工产品。工业上常利用含硫废水生产Na2S2O3?5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。烧瓶C中发生反应如下:Na2S(aq)+H2O
(15分)硫代硫酸钠是一种重要的化工产品。工业上常利用含硫废水生产Na2S2O3?5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
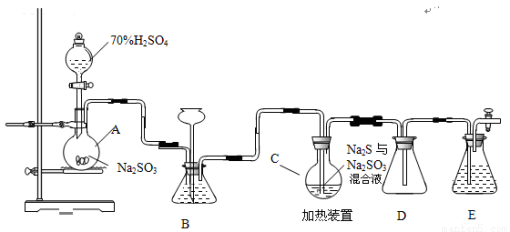
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq) Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成 一段液注,若 ,则整个装置气密性良好。装置D的作用是 。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)实验中,为使SO2缓慢进入烧瓶C,采用的操作是 。
(5)已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是 。
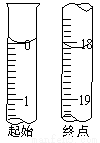
(6)反应终止后,烧瓶C中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有Na2S2O3?5H2O和其他杂质)。某兴趣小组为测定该产品纯度,准确称取4.96 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol?L?1碘的标准溶液滴定。反应原理为:2S2O32-+I2=S4O62-+2I?,滴定至终点时,滴定起始和终点的液面位置如下图,则产品的纯度为_________。
经仪器分析,该产品纯度为16%,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差) 。[M(Na2S2O3?5H2O)=248g/mol]
(1)液柱高度保持不变(1分) 防止倒吸(1分) NaOH(合理即得分)(1分)(2)2:1(2分)
c(2分)(4)控制滴加硫酸的速度(合理即得分)(2分) 溶液变澄清(或浑浊消失)(2分)
(6)18.1% (2分) 粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大(2分)
分 析:
(1)如果装置不漏气,则液注高度保持不变,据此可以说明气密性良好;SO2易溶于水,所以D为安全瓶,起防止倒吸的作用;SO2、H2S均是大气污染物,需要尾气处理,因此装置E起到吸收尾气中SO2、H2S的作用。二者都是酸性气体,应该选用NaOH溶液。
(2)根据题目所给3个化学反应方程式可得出对应关系:2Na2S ~ 2H2S ~ 3S ~3 Na2SO3,即2molNa2S反应时同时生成2molNa2SO3,还需要1molNa2SO3,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1。
(3)SO2易溶于水,能与Na2SO3溶液、NaHCO3溶液反应,但在NaHSO3溶液中溶解度较小,所以最好选用饱和亚硫酸氢钠溶液,答案选c;
(4)SO2利用70% H2SO4与Na2SO3反应制取,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度即可;
(5)反应(III)相对较慢,而反应III 是固体S与亚硫酸钠溶液反应,所以烧瓶C中反应达到终点的现象是溶液变澄清(或浑浊消失);
(6)根据示意图可知起始时读数是0.00ml,终点时读数是18.10ml,这说明实际消耗溶液的体积是18.10ml,所以Na2S2O3?5H2O的质量=0.1000mol/L×0.01810L×2×248g/mol=0.89776g,则产品的纯度为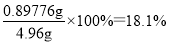 。如果经仪器分析,该产品纯度为16%,这说明测量值偏高,即消耗标准液的体积偏大,所以可能的原因是粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大。
。如果经仪器分析,该产品纯度为16%,这说明测量值偏高,即消耗标准液的体积偏大,所以可能的原因是粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大。
考点:
考查物质制备实验方案设计与探究
选出每组单词中划括号部分读音不同的一项.1.A:t(o)day.B:t(o)morrow.C:st 2020-04-26 …
O、A、B、C为空间四个点,又OA、OB、OC为空间的一个基底,则()A.O、A、B、C四点不共线 2020-05-14 …
商务礼仪作业:"细节决定成败,礼仪改变生活"这种说法是否正确?请结合实例,用相关礼仪知识加以回答! 2020-05-16 …
选出与所给单词划线部分读音相同的一项1、h(o)meA.c(o)meB.g(o)C.d(o)cto 2020-05-17 …
英语单词辨音找出画()部分读音与其余不同的单词()1.A .kn(ee) B.n(e)ck C.r 2020-05-17 …
如图是俄罗斯主要工业区示意图,下列关于俄罗斯工业区的叙述正确的是()A.O为圣彼得堡为中心的工业区 2020-07-01 …
已知AB是半径为6的⊙O的直径,点C是⊙O的半径OA上的动点,PC⊥AB交⊙O于E,交OA于C,P 2020-07-31 …
在第二周期中,B、C、N、O四种元素的第一电离能由大到小的排列顺序正确的是()A.I1(N)>I1( 2020-11-01 …
()是美容师职业活动的行为规范。A、美学修养B、礼仪规则C、专业要()是美容师职业活动的行为规范。A 2020-11-14 …
已知:AB为⊙O的直径,C是⊙O外一点,BC交⊙O于点E,AC交⊙O于点D,∠DOE=60º.求∠C 2020-11-27 …