早教吧作业答案频道 -->化学-->
乙酸是重要的有机化工原料之一,目前世界上一半以上的乙酸都采用甲醇与CO反应来制备.某实验小组在一个恒压密闭容器中加入0.20molCH3OH和0.22molCO气体,发生反应CH3OH(g)+CO(g)⇌CH3COOH(
题目详情
乙酸是重要的有机化工原料之一,目前世界上一半以上的乙酸都采用甲醇与CO反应来制备.
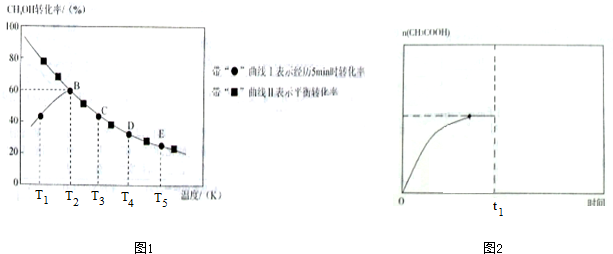
某实验小组在一个恒压密闭容器中加入0.20molCH3OH和0.22molCO气体,发生反应CH3OH(g)+CO(g)⇌CH3COOH(l),测得甲醇的转化率随温度的变化关系如图1所示,其中曲线I表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1529kJ•mol-1
CH3COOHH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-874kJ•mol-1
按要求回答下列问题:
(1)求工业制乙酸反应:CH3OH(g)⇌CH3COOH(l)△H___kJ•mol-1
(2)在温度为T3时,从反应开始至5min时,用单位时间内物质的量变化表示的乙酸的平均反应速率为___mol•min-1.
(3)在温度为T2时,该反应的平衡常数K=___,在T3温度下,C点时,v(正)___v(逆)
(4)曲线I在T1-T2阶段,甲醇转化率随温度变化升高的原因是___;
(5)在温度为T2时,往上述达到平衡的恒压容器中,再在瞬间通入0.12molCH3OH和0.06molCO混合气体,平衡的移动方向为___(填“向左”或“向右”或“不移动”),理由是___.
(6)在温度为T1时,乙酸的物质的量随时间变化的趋势曲线如图2所示,当时间到达t1时,将该反应体系温度迅速上升到T3,并维持该温度.请在图中画出t1时刻后乙酸物质的量的变化总趋势曲线.
某实验小组在一个恒压密闭容器中加入0.20molCH3OH和0.22molCO气体,发生反应CH3OH(g)+CO(g)⇌CH3COOH(l),测得甲醇的转化率随温度的变化关系如图1所示,其中曲线I表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.

已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1529kJ•mol-1
CH3COOHH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-874kJ•mol-1
按要求回答下列问题:
(1)求工业制乙酸反应:CH3OH(g)⇌CH3COOH(l)△H___kJ•mol-1
(2)在温度为T3时,从反应开始至5min时,用单位时间内物质的量变化表示的乙酸的平均反应速率为___mol•min-1.
(3)在温度为T2时,该反应的平衡常数K=___,在T3温度下,C点时,v(正)___v(逆)
(4)曲线I在T1-T2阶段,甲醇转化率随温度变化升高的原因是___;
(5)在温度为T2时,往上述达到平衡的恒压容器中,再在瞬间通入0.12molCH3OH和0.06molCO混合气体,平衡的移动方向为___(填“向左”或“向右”或“不移动”),理由是___.
(6)在温度为T1时,乙酸的物质的量随时间变化的趋势曲线如图2所示,当时间到达t1时,将该反应体系温度迅速上升到T3,并维持该温度.请在图中画出t1时刻后乙酸物质的量的变化总趋势曲线.
▼优质解答
答案和解析
(1)①2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1529kJ•mol-1
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-874kJ•mol-1
由(②+①)÷2-③得,CH3OH(g)+CO(g)⇌CH3COOH(l)△H=
-(-874kJ•mol-1)=-173.5kJ•mol-1,
故答案为:-173.5;
(2)由曲线Ⅰ可知:T2温度下,5min时测得的甲醇的转化率为60%,故转化的甲醇的物质的量为0.20mol×60%=0.12mol,则生成乙酸的物质的量为0.12mol,故在温度为T3时,从反应开始至5min时,用单位时间内物质的量变化表示的乙酸的平均反应速率为
=0.024mol•min-1,
故答案为:0.024;
(3)由解答(2)可知:在温度为T2时,转化的甲醇的物质的量为0.12mol,则转化的CO的物质的量为0.12mol,故平衡时甲醇的物质的量为0.20mol-0.12mol=0.08mol,CO的物质的量为0.22mol-0.12mol=0.1mol,故平衡常数K=
=
=500;
在T3温度下,C点时反应已达平衡状态,故正逆反应速率相等,故v(正)=v(逆),
故答案为:500;=;
(4)由曲线Ⅰ可知:T1温度下,5min时,反应未达平衡状态,故升高温度,化学反应速率加快,故甲醇转化率随温度的升高而增大,
故答案为:反应未达平衡状态,故升高温度,化学反应速率加快,故甲醇转化率随温度的升高而增大;
(5)原平衡体系,气体总的物质的量为0.08mol+0.1mol=0.18mol,体积为2L,
在温度为T2时,往上述达到平衡的恒压容器中,再在瞬间通入0.12molCH3OH和0.06molCO混合气体,充入气体总的物质的量为0.12mol+0.06mol=0.18mol,原平衡相等,故体积变为原来的2倍,此时,甲醇的物质的量为0.08mol+0.12mol=0.2mol,CO的物质的量为0.1mol+0.06mol=0.16mol,则Qc=
=500=K,故平衡不移动;
故答案为:不移动;加入气体的总物质的量与原平衡气体的总物质的量相等,体积变为4L,Qc=Qc=
=500=K;
(6)当时间到达t1时,将该反应体系温度迅速上升到T3,并维持该温度,温度升高,平衡逆向移动,乙酸的物质的量减小,一段时间后达到平衡状态,乙酸的物质的量保持不变,故t1时刻后的变化总趋势曲线为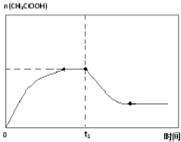 ,故答案为:
,故答案为: .
.
②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1529kJ•mol-1
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-874kJ•mol-1
由(②+①)÷2-③得,CH3OH(g)+CO(g)⇌CH3COOH(l)△H=
| (-566kJ•mol-1)+(-1529kJ•mol-1) |
| 2 |
故答案为:-173.5;
(2)由曲线Ⅰ可知:T2温度下,5min时测得的甲醇的转化率为60%,故转化的甲醇的物质的量为0.20mol×60%=0.12mol,则生成乙酸的物质的量为0.12mol,故在温度为T3时,从反应开始至5min时,用单位时间内物质的量变化表示的乙酸的平均反应速率为
| 0.12mol |
| 5min |
故答案为:0.024;
(3)由解答(2)可知:在温度为T2时,转化的甲醇的物质的量为0.12mol,则转化的CO的物质的量为0.12mol,故平衡时甲醇的物质的量为0.20mol-0.12mol=0.08mol,CO的物质的量为0.22mol-0.12mol=0.1mol,故平衡常数K=
| 1 |
| c(CH3OH)•c(CO) |
| 1 | ||||
|
在T3温度下,C点时反应已达平衡状态,故正逆反应速率相等,故v(正)=v(逆),
故答案为:500;=;
(4)由曲线Ⅰ可知:T1温度下,5min时,反应未达平衡状态,故升高温度,化学反应速率加快,故甲醇转化率随温度的升高而增大,
故答案为:反应未达平衡状态,故升高温度,化学反应速率加快,故甲醇转化率随温度的升高而增大;
(5)原平衡体系,气体总的物质的量为0.08mol+0.1mol=0.18mol,体积为2L,
在温度为T2时,往上述达到平衡的恒压容器中,再在瞬间通入0.12molCH3OH和0.06molCO混合气体,充入气体总的物质的量为0.12mol+0.06mol=0.18mol,原平衡相等,故体积变为原来的2倍,此时,甲醇的物质的量为0.08mol+0.12mol=0.2mol,CO的物质的量为0.1mol+0.06mol=0.16mol,则Qc=
| 1 | ||||
|
故答案为:不移动;加入气体的总物质的量与原平衡气体的总物质的量相等,体积变为4L,Qc=Qc=
| 1 | ||||
|
(6)当时间到达t1时,将该反应体系温度迅速上升到T3,并维持该温度,温度升高,平衡逆向移动,乙酸的物质的量减小,一段时间后达到平衡状态,乙酸的物质的量保持不变,故t1时刻后的变化总趋势曲线为
 ,故答案为:
,故答案为: .
.
看了乙酸是重要的有机化工原料之一,...的网友还看了以下:
《傅雷家书》的主要人物及性格主要人物最少要3个以上 2020-04-27 …
有没有三角形的例子?要3个以上!要3个以上!3个不行! 2020-05-13 …
拭目以待的英文Itwhethertheylikeitornot?他们...要拭目以待 2020-05-22 …
他们能否享受旅行还要拭目以待英语翻译 2020-05-22 …
找几个英语单词.要求:开头字母必须一样;意思就要褒意的像(诚信,诚实,友情,团结,无畏)等类型的! 2020-07-02 …
英语翻译1.他离开了公司,下定决心再也不回来.2.是否我们能筹集到钱还要拭目以待.3.他的梦想就是 2020-07-10 …
求1,2,3,5,6,8,开头的六位数字的组合!知道多少写多少!不要连续的数字,不要3个以上重复的 2020-07-10 …
层层递进的排比句,要3句以上,急!层层递进的排比句,短一些不要紧,要快!一定要3句以上,不能是4句! 2020-12-28 …
完壁归赵和渑池之会以及负荆请罪有什么联系吗?简短点,不要太长了~OK?I服了YOU~你们太简短了.我 2020-12-31 …
世界名著,要是中国的!一个精彩片段,起码要3段以上,6段以下!要打上:(中国)作者《》例:(中国)高 2021-01-15 …