早教吧作业答案频道 -->化学-->
根据金属有关知识填空.(1)铝和铝合金中硬度较大的是.(2)磁铁矿的主要成分是(填化学式).(3)生活中我们要用化学方法除去铁锈的化学方程式是.(4)如图探究铁生锈
题目详情
根据金属有关知识填空.
(1)铝和铝合金中硬度较大的是___.
(2)磁铁矿的主要成分是___(填化学式).
(3)生活中我们要用化学方法除去铁锈的化学方程式是___.
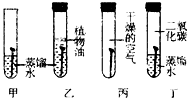
(4)如图探究铁生锈条件实验中多用蒸馏水要预先煮沸,其目的是___;设计实验探究空气中的二氧化碳没有参与铁的生锈过程,如图所示四个实验中有必要做的是___.
(5)铝、铁、铜中活动性最强的是___,年产量最高的___,将铁加入稀硫酸中,最终得到___色溶液,若将铝、铁、铜三种金属同时放入硝酸铜溶液中,完全反应后,金属铁有剩余,则此时溶液中的溶质最多有___种.

(1)铝和铝合金中硬度较大的是___.
(2)磁铁矿的主要成分是___(填化学式).
(3)生活中我们要用化学方法除去铁锈的化学方程式是___.
(4)如图探究铁生锈条件实验中多用蒸馏水要预先煮沸,其目的是___;设计实验探究空气中的二氧化碳没有参与铁的生锈过程,如图所示四个实验中有必要做的是___.
(5)铝、铁、铜中活动性最强的是___,年产量最高的___,将铁加入稀硫酸中,最终得到___色溶液,若将铝、铁、铜三种金属同时放入硝酸铜溶液中,完全反应后,金属铁有剩余,则此时溶液中的溶质最多有___种.
▼优质解答
答案和解析
(1)合金的硬度比组成合金的纯金属硬度大,即铝合金的硬度比纯铝大,故填:铝合金;
(2)磁铁矿的主要成分是四氧化三铁;故填:Fe3O4;
(3)铁锈的主要成分是氧化铁,盐酸能与氧化铁反应生成氯化铁和水,可以清除铁锈,故填:6HCl+Fe2O3=2FeCl3+3H2O;
(4)水中溶解有氧气,加热的目的是除去水中溶解的氧气,要证明二氧化碳没有参加反应,需要进行二氧化碳与水接触以及二氧化碳与水和氧气同时接触的实验,故填:除去水中溶解的氧气;甲、丁;
(5)铝、铁、铜中活动性最强的是铝,年产量最高的铁;铁与稀硫酸反应生成硫酸亚铁和氢气,硫酸亚铁溶液的颜色是浅绿色;根据金属活动性,硝酸铜先和铝反应,再与铁发生反应,铁粉过量,所以说明铝完全反应,一部分铁反应;反应后的溶液中不再含的Cu(NO3)2,而是含有生成的Al(NO3)3、Fe(NO3)2;故溶液中的溶质有2种;故填:铝;铁;浅绿;2.
(2)磁铁矿的主要成分是四氧化三铁;故填:Fe3O4;
(3)铁锈的主要成分是氧化铁,盐酸能与氧化铁反应生成氯化铁和水,可以清除铁锈,故填:6HCl+Fe2O3=2FeCl3+3H2O;
(4)水中溶解有氧气,加热的目的是除去水中溶解的氧气,要证明二氧化碳没有参加反应,需要进行二氧化碳与水接触以及二氧化碳与水和氧气同时接触的实验,故填:除去水中溶解的氧气;甲、丁;
(5)铝、铁、铜中活动性最强的是铝,年产量最高的铁;铁与稀硫酸反应生成硫酸亚铁和氢气,硫酸亚铁溶液的颜色是浅绿色;根据金属活动性,硝酸铜先和铝反应,再与铁发生反应,铁粉过量,所以说明铝完全反应,一部分铁反应;反应后的溶液中不再含的Cu(NO3)2,而是含有生成的Al(NO3)3、Fe(NO3)2;故溶液中的溶质有2种;故填:铝;铁;浅绿;2.
看了根据金属有关知识填空.(1)铝...的网友还看了以下:
一道数学题题,急死了!某钱币收藏爱好者想把3.5元纸币兑换成1分,2分,5分的硬币.他要求硬币总数 2020-06-03 …
帮忙做道小学数学题吧.小方用一元硬币排成一个三层空心方阵,最外面一层每边14枚问小方一共要用多少硬 2020-06-05 …
1.用一根长48厘米的铁丝做成一个正方体的框架,并用硬纸板糊在六个面上,至少需要用硬纸板多少平方厘 2020-06-28 …
数学应用题,要快1.用一根长48厘米长的铁丝做成一个正方体的框架,并用硬纸板糊在六个面上,至少要用 2020-07-05 …
小明用1元硬币排成一个三层空心方阵,最外面一层每边14枚,要摆成这个方阵共要用1元硬币多少枚? 2020-11-02 …
区分软水和硬水的最简便的方法是.若,则为软水,若,则为硬水.要使硬水软化成软水,可采用的方法很多,它 2020-11-05 …
一个正方体礼品盒,棱长1.2分米.礼品盒的四周和底面用的是硬纸板,上面用的是玻璃.做这个礼品盒至少要 2020-11-05 …
区分软水和硬水的最简便的方法是.若,则为软水,若,则为硬水.要使硬水软化成软水,可采用的方法很多,它 2020-12-03 …
100积分2题,用一根48厘米长的铁丝做成一个正方体的框架.用硬纸糊在六个面上,至少要用硬纸板多少平 2020-12-05 …
小明是位钱币收藏爱好者,他想把自己的零用钱3.5元纸币兑换成1分,2分,5分的硬币,他要求硬币总数为 2020-12-27 …