早教吧作业答案频道 -->化学-->
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:元素相关信息TT元素可形成自然界硬度最大的单质WW与T同周期,核外有一个未
题目详情
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
(1)TY2是一种常用的溶剂,是___(填“极性分子”或“非极性分子”),分子中存在___个σ 键.W的最简单氢化物容易液化,理由是___.
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为___.
(3)基态Y原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___、电子数为___.Y、氧、W元素的电负性由大到小顺序为___(用元素符号作答).
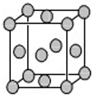
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g•cm3,则晶胞边长为___(用含立方根的式子表示);ZYO4常作电镀液,其中YO42-的空间构型是___,其中Y原子的杂化轨道类型是___.Z的单质与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2═ZCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示正确的是___
A.O2是氧化剂
B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1molZ参加反应有1mol电子发生转移.
| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ•mol,I2=1817kJ•mol-1,I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为___.
(3)基态Y原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___、电子数为___.Y、氧、W元素的电负性由大到小顺序为___(用元素符号作答).
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g•cm3,则晶胞边长为___(用含立方根的式子表示);ZYO4常作电镀液,其中YO42-的空间构型是___,其中Y原子的杂化轨道类型是___.Z的单质与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2═ZCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示正确的是___
A.O2是氧化剂
B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1molZ参加反应有1mol电子发生转移.

▼优质解答
答案和解析
(1)CS2中存两个碳硫双键,碳原子没有孤电子对,所以CS2是非极性分子,分子中存在2个σ 键,W为氟元素,由于氟化氢分子之间存在着氢键,所以氟化氢容易液化,
故答案为:非极性分子;2;氟化氢分子之间存在着氢键;
(2)13.5g的Al的物质的量为
=0.5mol,4molAl在O2气体中完全燃烧后恢复至原状态放出的热量为419kJ×
=3352kJ,故热化学方程式为:4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol,
故答案为:4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol;
(3)Y为硫元素,基态Y原子中,核外有三个电子层,电子占据的最高能层符号是M,M能层具有spd三个能级,s上有一个轨道,p上有三个轨道,d上有5个原子轨道,所以共有9个,硫原子的最外层电子数为6,S、0、F元素的第一电离能由大到小顺序为 F>O>S,
故答案为:M;9; 6; F>O>S;
(4)Z为铜元素,根据铜的晶胞结构图可知,每个晶胞中含有铜原子数为
=4,所以晶胞的体积为
cm3=4.72×10-23 cm3,所以晶胞的边长为
cm,SO42-中,硫原子的价层电子对数为4+
=4,硫原子没有孤电子对,所以空间构型为正四面体,S原子的杂化轨道类型是sp3杂化,在反应Cu+HCl+O2=CuCl+HO2中,
A.O2是氧化剂,故A正确;
B.HO2是还原产物,故B错误;
C.HO2 (超氧酸)是一种弱酸,所以HO2在碱中有能稳定存在,故C错误;
D.1mol Cu参加反应被氧化成亚铜郭,有1mol电子发生转移,故D正确,
故答案为:
cm;正四面体;sp3;AD.
故答案为:非极性分子;2;氟化氢分子之间存在着氢键;
(2)13.5g的Al的物质的量为
| 13.5g |
| 27g/mol |
| 4mol |
| 0.5mol |
故答案为:4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol;
(3)Y为硫元素,基态Y原子中,核外有三个电子层,电子占据的最高能层符号是M,M能层具有spd三个能级,s上有一个轨道,p上有三个轨道,d上有5个原子轨道,所以共有9个,硫原子的最外层电子数为6,S、0、F元素的第一电离能由大到小顺序为 F>O>S,
故答案为:M;9; 6; F>O>S;
(4)Z为铜元素,根据铜的晶胞结构图可知,每个晶胞中含有铜原子数为
| 1 |
| 8 |
| ||
| 9.00 |
| 3 | 4.72×10-23 |
| 6+2-4×2 |
| 2 |
A.O2是氧化剂,故A正确;
B.HO2是还原产物,故B错误;
C.HO2 (超氧酸)是一种弱酸,所以HO2在碱中有能稳定存在,故C错误;
D.1mol Cu参加反应被氧化成亚铜郭,有1mol电子发生转移,故D正确,
故答案为:
| 3 | 4.72×10-23 |
看了T、W、X、Y、Z是元素周期表...的网友还看了以下:
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3 2020-04-08 …
短周期元素x、Y、Z、R、T、M、W在周期表中的位置如图所示:(1)元素周期表有个周期,个族;(2 2020-04-08 …
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X 2020-04-08 …
X、Y、Z、W为四种短周期元素.X原子最外层电子数是核外电子层数的3倍;Y最高价与最低价的代数和为 2020-04-08 …
关于正玄(sin)的周期的公式分析正玄(sin)的周期为2派/w=T.2派代表什么,w又代表什么. 2020-07-02 …
有X、Y、Z、W四种短周期主族元素,原子序数依次增大.其中X、Z同主族,Y、W同周期,X原子的最外 2020-07-13 …
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下 2020-07-20 …
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形 2020-11-17 …
已知短周期中相邻元素X、Y、Z、W,其原子序数依次增大,其中X、Y、Z三种元素的质子数之和为21,X 2020-12-21 …
(24分)X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,X、W在周期表中的相对位置如下表;X 2021-01-05 …