早教吧作业答案频道 -->化学-->
短周期的五种元素A、B、C、D、E,原子序数依次增大.A、B、C三种元素电子层数之和是5.A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它
题目详情
短周期的五种元素A、B、C、D、E,原子序数依次增大.A、B、C三种元素电子层数之和是5.A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1:1和2:1的两种液态化合物;E单质用于净化水质.
请回答:
(1)写出D在元素周期表中的位置___,E的原子结构示意图是___.下列可以验证C与D两元素原子得电子能力强弱的实验事实是___(填写编号).
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式___.
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为___,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为___.
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式___.
②上述反应生成的两种碱继续作用,得到Fe3O4.
(5)已知下表数据:
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0mol•L-1,则混合液中c(OH-)不得大于___ mol•L-1.
请回答:
(1)写出D在元素周期表中的位置___,E的原子结构示意图是___.下列可以验证C与D两元素原子得电子能力强弱的实验事实是___(填写编号).
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式___.
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为___,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为___.
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式___.
②上述反应生成的两种碱继续作用,得到Fe3O4.
(5)已知下表数据:
| 物质 | Fe(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 2.0×10-16 | 4.0×10-36 |
▼优质解答
答案和解析
短周期元素A、B、C、D、E原子序数依次增大,B元素原子最外电子层上的电子数是它的电子层数的2倍,则B为碳元素或硫元素,因为B后面有C、D、E三种元素都是短周期元素,所以B为C元素;A与D可以形成原子个数比分别为1:1和2:1的两种液态化合物,则A为H元素,D为O元素;由于C元素原子序数介于B、D之间,所以C为N元素,E单质用于净化水质,则E为氯Cl元素,
(1)D为O元素,在元素周期表中位于第二周期VIA族;E为Cl元素,氯原子的核电荷数为17,最外层含有7个电子,氯原子结构示意图为: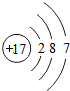 ;
;
A.氢化物的沸点与非金属性强弱没有必然关系,所以无法通过比较这两种元素的气态氢化物的沸点判断非金属性强弱,故A错误;
B.D为O元素、C为D元素,比较只有这两种元素所形成的化合物中的化合价,显示负价的说明其非金属性较强,故B正确;
C.非金属性越强,对应的气态氢化物越稳定,可以通过比较这两种元素的气态氢化物的稳定性判断其非金属性强弱,故C正确;
D.非金属性越强,与氢气形成气态氢化物越容易,可以通过比较这两种元素的单质与氢气化合的难易判断其非金属性强弱,故D正确;
故答案为:第二周期VIA族; ;BCD;
;BCD;
(2)由A、B两种元素组成的最简单的化合物为甲烷,甲烷为共价化合物,其电子式为: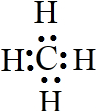 ,
,
故答案为: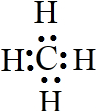 ;
;
(3)由A、B、C、D四种元素组成的无机盐甲,既能与盐酸反应又可以与NaOH溶液反应,其化学式为 NH4HCO3或(NH4)2 CO3;
乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,则乙为甘氨酸,其化学式为:NH2-CH2-COOH,
故答案为:NH4HCO3或(NH4)2CO3;NH2-CH2-COOH;
(4)①CA3为氨气,NH3的水溶液显碱性,可以将Fe2+、Fe3+转化成Fe(OH)2和Fe(OH)3沉淀,在等物质的量的FeSO4和Fe2(SO4)3组成的混合溶液中,反应总离子方程式为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+,
故答案为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+;
(5)亚铁离子和铁离子的浓度分别是2.0mol/L和4.0mol/L,所以根据溶度积常数可知,相应OH-浓度分别为:
mol/L=10-8mol/L、
mol/L=10-12mol/L,所以混合液中c(OH-)不得大于10-12mol/L,
故答案为:10-12.
(1)D为O元素,在元素周期表中位于第二周期VIA族;E为Cl元素,氯原子的核电荷数为17,最外层含有7个电子,氯原子结构示意图为:
 ;
;A.氢化物的沸点与非金属性强弱没有必然关系,所以无法通过比较这两种元素的气态氢化物的沸点判断非金属性强弱,故A错误;
B.D为O元素、C为D元素,比较只有这两种元素所形成的化合物中的化合价,显示负价的说明其非金属性较强,故B正确;
C.非金属性越强,对应的气态氢化物越稳定,可以通过比较这两种元素的气态氢化物的稳定性判断其非金属性强弱,故C正确;
D.非金属性越强,与氢气形成气态氢化物越容易,可以通过比较这两种元素的单质与氢气化合的难易判断其非金属性强弱,故D正确;
故答案为:第二周期VIA族;
 ;BCD;
;BCD;(2)由A、B两种元素组成的最简单的化合物为甲烷,甲烷为共价化合物,其电子式为:
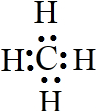 ,
,故答案为:
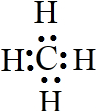 ;
;(3)由A、B、C、D四种元素组成的无机盐甲,既能与盐酸反应又可以与NaOH溶液反应,其化学式为 NH4HCO3或(NH4)2 CO3;
乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,则乙为甘氨酸,其化学式为:NH2-CH2-COOH,
故答案为:NH4HCO3或(NH4)2CO3;NH2-CH2-COOH;
(4)①CA3为氨气,NH3的水溶液显碱性,可以将Fe2+、Fe3+转化成Fe(OH)2和Fe(OH)3沉淀,在等物质的量的FeSO4和Fe2(SO4)3组成的混合溶液中,反应总离子方程式为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+,
故答案为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+;
(5)亚铁离子和铁离子的浓度分别是2.0mol/L和4.0mol/L,所以根据溶度积常数可知,相应OH-浓度分别为:
|
| 3 |
| ||
故答案为:10-12.
看了短周期的五种元素A、B、C、D...的网友还看了以下:
W、X、Y、Z、R属于短周期元素.已知它们都不是稀有气体元素,W的原子半径是短周期中最大,X元素的 2020-04-08 …
某短周期元素最低负价为-2价,该元素的离子跟其核外电子排布相同的离子形成的化合物是()A.K2SB 2020-04-08 …
现有部分元素的存在、性质或原子结构如表所示:A最外层电子数是次外层电子数的2倍的元素B最高正价为+ 2020-04-08 …
一道化学题目关于元素的12.有三种短周期元素,最外层电子数之和为17,质子数之和为31.如果这三种 2020-05-16 …
有ABC三种短周期元素,最外层电子数之和为17质子数之和为31已知c为Ar则若A为金属元素,则B是 2020-05-23 …
.在元素周期表中,每一周期的元素个数正好等于该周期元素最外电子层轨道可以容纳的电子个数.这句话怎么 2020-06-09 …
为什么同一周期元素最外层电子越多半径越小 2020-07-30 …
图是部分短周期元素最高价氧化物对应水化物的等物质的量浓度稀溶液pH与原子序数的关系图,Z的氧化物是两 2020-11-02 …
如图是常温下等物质的量浓度的部分短周期元素最高价氧化物对应水化物的稀溶液的pH与原子序数的关系图,Z 2020-11-02 …
某短周期元素最高正价与最低负价的绝对值之差为6,该元素的离子与跟其核外电子排布相同的离子形成的化合物 2020-12-31 …