早教吧作业答案频道 -->化学-->
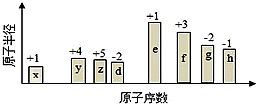
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题:(1)f在元素周期表的位置是.(2)
题目详情
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题:
(1)f 在元素周期表的位置是___.
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:___>___>___.(用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为___;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为___.(填序号)
A.MnO2B.FeCl3C.Na2SO3D.KMnO4
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: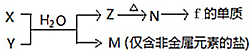
①X溶液与Y溶液反应的离子方程式为___
②常温下,为使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至___
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL 1mol•L-1 R溶液的烧杯中滴加1mol•L-1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示:
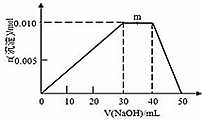
①写出m点反应的离子方程式___.
②若R溶液中改加20mL 1.2mol•L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为___mol.

(1)f 在元素周期表的位置是___.
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:___>___>___.(用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为___;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为___.(填序号)
A.MnO2B.FeCl3C.Na2SO3D.KMnO4
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
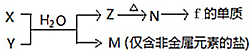
①X溶液与Y溶液反应的离子方程式为___
②常温下,为使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至___
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL 1mol•L-1 R溶液的烧杯中滴加1mol•L-1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示:

①写出m点反应的离子方程式___.
②若R溶液中改加20mL 1.2mol•L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为___mol.
▼优质解答
答案和解析
从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族,
故答案为:第三周期ⅢA族;
(2)非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4>H2CO3,
故答案为:HClO4>H2SO4>H2CO3;
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,则A为Na2O2,其电子式为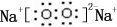 ,B是常见的液态化合物,其稀溶液易被催化分解,则B为H2O2,能使双氧水解的催化剂为MnO2、FeCl3,故选AB,
,B是常见的液态化合物,其稀溶液易被催化分解,则B为H2O2,能使双氧水解的催化剂为MnO2、FeCl3,故选AB,
故答案为: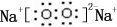 ;AB;
;AB;
(4)①由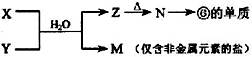 反应转化可知,f为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
反应转化可知,f为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
②M溶液中铵根离子水解呈酸性,要使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,根据溶液的电中性可知c(H+)=c(OH-),所以应向溶液中加入一定量的Y溶液至溶液呈中性,
故答案为:溶液呈中性;
(5)①m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O,离子方程式为:NH4++OH-=NH3•H2O,
故答案为:NH4++OH-=NH3•H2O;
②10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2 mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022.
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族,
故答案为:第三周期ⅢA族;
(2)非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4>H2CO3,
故答案为:HClO4>H2SO4>H2CO3;
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,则A为Na2O2,其电子式为
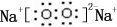 ,B是常见的液态化合物,其稀溶液易被催化分解,则B为H2O2,能使双氧水解的催化剂为MnO2、FeCl3,故选AB,
,B是常见的液态化合物,其稀溶液易被催化分解,则B为H2O2,能使双氧水解的催化剂为MnO2、FeCl3,故选AB,故答案为:
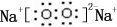 ;AB;
;AB;(4)①由
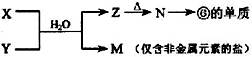 反应转化可知,f为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
反应转化可知,f为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
②M溶液中铵根离子水解呈酸性,要使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,根据溶液的电中性可知c(H+)=c(OH-),所以应向溶液中加入一定量的Y溶液至溶液呈中性,
故答案为:溶液呈中性;
(5)①m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O,离子方程式为:NH4++OH-=NH3•H2O,
故答案为:NH4++OH-=NH3•H2O;
②10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2 mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022.
看了随原子序数的递增,八种短周期元...的网友还看了以下:
对于数列{an},如果存在最小的一个常数T(T∈N*),使得对任意的正整数恒有an+T=an成立, 2020-05-13 …
在下列语句中,叙述正确的个数为()①相等的圆周角所对弧相等;②同圆或等圆中,同弦或等弦所对圆周角相 2020-06-06 …
y=cosx的最小正周期和y=sinx的最小正周期是什么?y=cosx的最小正周期和y=sinx的 2020-06-07 …
对于数列,如果存在一个正整数,使得对任意的都有成立,那么就把这样一类数列称作周期为的周期数列,的最 2020-06-11 …
下列各项对西周分封制的评述,正确的是()1诸侯国起着拱的作用2诸侯必须制定期到周室朝舰3各诸侯1诸 2020-07-04 …
已知函数y=sin(x−π12)cos(x−π12),则下列判断正确的是()A.此函数的最小正周期 2020-07-30 …
下列语句中不正确的有()①长度相等的两条弧是等弧②平分弦的直径垂直于弦③直径所对的圆周角是直角④一 2020-07-31 …
确定百分百对的来!关于周期函数,下列说法正确的是:a.周期函数的周期都不止一个b.周期函数的定义域 2020-08-02 …
已知函数,则下列判断正确的是()A、其最小正周期为,图象的一个对称中心是B、其最小正周期为,图象的 2020-08-03 …
关于最少正周期“对于一个函数f(x),如果它所有的周期中存在一个最小的正数,那么这个最小正数叫f(x 2020-11-15 …