早教吧作业答案频道 -->化学-->
现有A、B、C、D、E、F、G七种元素,其中A、B、C、D、E、F为短周期元素且原子序数依次增大:A的最高正价与最低负价的代数和为零;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既
题目详情
现有A、B、C、D、E、F、G七种元素,其中A、B、C、D、E、F为短周期元素且原子序数依次增大:A的最高正价与最低负价的代数和为零;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应;常温下D2是气体,标况时D2气体的密度约是1.43g/L;E原子半径在同周期中除稀有气体外最大,F原子M层上的电子比K层多5个.金属G的合金在生活中用量最大,用途最广.
(1)G在元素周期表中的位置是___,画出F的离子结构示意图___;
(2)D、E、F离子半径由大到小顺序为:___>___>___(用离子符号表示);
(3)A与D可形成原子个数比为1:l的化合物,用电子式表示该化合物的形成过程:___;
(4)D与E形成某离子化合物H具有漂白性,写出H的电子式___,该化合物和B与D形成的某化合物反应的化学方程式为:___,lmolH发生该反应转移电子数为___;
(5)若X为正盐,X中含有的化学键类型为___;
(6)B和F两种元素相比较,原子得电子能力较强的为___(填元素名称),以下三种说法中,可以验证B和F得电子能力强弱的是___(填写编号);
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,F元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(7)金属元素G可与F形成化合物GF3.将G的单质与石墨用导线相连浸入GF3溶液中形成一个原电池.该原电池工作时,石墨一极发生的反应可以表示为___,当有l.2mole-转移时单质G质量变化为___g;
(8)用A元素的单质与D元素的常见单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入A的单质,乙极通入D的单质,则甲极的电极反应式为:___.
(1)G在元素周期表中的位置是___,画出F的离子结构示意图___;
(2)D、E、F离子半径由大到小顺序为:___>___>___(用离子符号表示);
(3)A与D可形成原子个数比为1:l的化合物,用电子式表示该化合物的形成过程:___;
(4)D与E形成某离子化合物H具有漂白性,写出H的电子式___,该化合物和B与D形成的某化合物反应的化学方程式为:___,lmolH发生该反应转移电子数为___;
(5)若X为正盐,X中含有的化学键类型为___;
(6)B和F两种元素相比较,原子得电子能力较强的为___(填元素名称),以下三种说法中,可以验证B和F得电子能力强弱的是___(填写编号);
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,F元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(7)金属元素G可与F形成化合物GF3.将G的单质与石墨用导线相连浸入GF3溶液中形成一个原电池.该原电池工作时,石墨一极发生的反应可以表示为___,当有l.2mole-转移时单质G质量变化为___g;
(8)用A元素的单质与D元素的常见单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入A的单质,乙极通入D的单质,则甲极的电极反应式为:___.
▼优质解答
答案和解析
A、B、C、D、E、F、G七种元素,其中A、B、C、D、E、F为短周期元素且原子序数依次增大:A的最高正价与最低负价的代数和为零,则A为H元素为第IVA族元素;常温下D2是气体,标况时D2气体的密度约是1.43g/L,其摩尔质量=1.43g/L×22.4L/mol=32g/mol,为O元素;
B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应,B、C原子序数小于氧元素,则B的最高价氧化物是二氧化碳、C的氢化物是氨气,二者反应生成碳酸铵或碳酸氢铵,X为正盐,则X是碳酸铵,所以B是C、C是N元素,则A是H元素;
F原子M层上的电子比K层多5个,且为短周期元素,则F是Cl元素;E原子序数小于F,
E原子半径在同周期中除稀有气体外最大,则E是Na元素;
金属G的合金在生活中用量最大,用途最广,则G是Fe元素,
(1)G是Fe元素,在元素周期表中的位置是第四周期第VIII族,F离子为氯离子,氯离子核外有3个电子层、最外层电子数是8,则Cl元素的离子结构示意图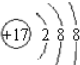 ,
,
故答案为:第四周期第VIII族;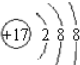 ;
;
(2)D、E、F分别是氧离子、钠离子和氯离子,离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,氯离子有3个电子层,而钠离子和氧离子有2个电子层,则D、E、F离子半径由大到小顺序为:Cl->O2->Na+,
故答案为:Cl-;O2-;Na+;
(3)H与O可形成原子个数比为1:l的化合物过氧化氢,H、O原子通过共用电子对形成过氧化氢,用电子式表示该化合物的形成过程: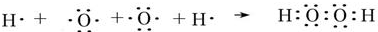 ,
,
故答案为: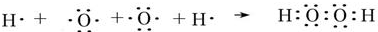 ;
;
(4)O与Na形成某离子化合物H具有漂白性,H为过氧化钠,过氧化钠中含有离子键和共价键,则H的电子式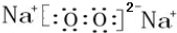 ,该化合物和B与D形成的某化合物二氧化碳反应生成碳酸钠和氧气,该反应化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,过氧化钠和二氧化碳的反应中有一半的过氧化钠作氧化剂,另一半作还原剂,1mol过氧化钠反应转移电子1mol,则lmolH发生该反应转移电子数为6.02×1023 或 NA,
,该化合物和B与D形成的某化合物二氧化碳反应生成碳酸钠和氧气,该反应化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,过氧化钠和二氧化碳的反应中有一半的过氧化钠作氧化剂,另一半作还原剂,1mol过氧化钠反应转移电子1mol,则lmolH发生该反应转移电子数为6.02×1023 或 NA,
故答案为: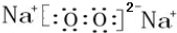 ;2Na2O2+2CO2=2Na2CO3+O2;6.02×1023 或 NA;
;2Na2O2+2CO2=2Na2CO3+O2;6.02×1023 或 NA;
(5)若X为正盐,为碳酸铵,碳酸铵中含有离子键和共价键,故答案为:离子键和共价键;
(6)N和Cl两种元素相比较,原子得电子能力较强的为氯,
a.这两种元素的单质都是分子晶体,单质的熔沸点与分子间作用力有关,与得电子难易程度无关,所以不能比较得电子能力强弱,故错误;
b.二者形成的化合物中,F元素的原子显负价,说明F元素得电子能力大于B,故正确;
c.比较这两种元素的气态氢化物的稳定性,元素的非金属性越强,其氢化物的稳定性越强,所以可以其得电子能力强弱,故正确;
故答案为:氯;bc;
(7)金属元素Fe可与Cl形成化合物FeCl3,将Fe与石墨用导线相连浸入FeCl3溶液中形成一个原电池,该原电池工作时,Fe作负极、石墨作正极,负极上Fe失电子发生氧化反应,正极上铁离子得电子发生还原反应,则石墨一极发生的反应可以表示为2Fe3++2e-═2Fe2+,根据离子方程式2Fe3++Fe═3Fe2+知,当Fe溶解56gFe时转移2mol电子,则当有l.2mole-转移时单质G质量变化=
×56g/mol=33.6g,
故答案为:2Fe3++2e-═2Fe2+;33.6;
(8)氢氧燃料碱性电池中,通入氢气的电极是负极、通入氧气的电极是正极,则甲为负极、乙为正极,负极反应式为H2-2e-+2OH-=2 H2O,
故答案为:H2-2e-+2OH-=2 H2O.
B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应,B、C原子序数小于氧元素,则B的最高价氧化物是二氧化碳、C的氢化物是氨气,二者反应生成碳酸铵或碳酸氢铵,X为正盐,则X是碳酸铵,所以B是C、C是N元素,则A是H元素;
F原子M层上的电子比K层多5个,且为短周期元素,则F是Cl元素;E原子序数小于F,
E原子半径在同周期中除稀有气体外最大,则E是Na元素;
金属G的合金在生活中用量最大,用途最广,则G是Fe元素,
(1)G是Fe元素,在元素周期表中的位置是第四周期第VIII族,F离子为氯离子,氯离子核外有3个电子层、最外层电子数是8,则Cl元素的离子结构示意图
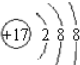 ,
,故答案为:第四周期第VIII族;
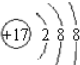 ;
;(2)D、E、F分别是氧离子、钠离子和氯离子,离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,氯离子有3个电子层,而钠离子和氧离子有2个电子层,则D、E、F离子半径由大到小顺序为:Cl->O2->Na+,
故答案为:Cl-;O2-;Na+;
(3)H与O可形成原子个数比为1:l的化合物过氧化氢,H、O原子通过共用电子对形成过氧化氢,用电子式表示该化合物的形成过程:
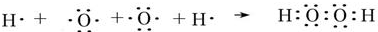 ,
,故答案为:
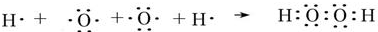 ;
;(4)O与Na形成某离子化合物H具有漂白性,H为过氧化钠,过氧化钠中含有离子键和共价键,则H的电子式
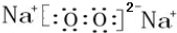 ,该化合物和B与D形成的某化合物二氧化碳反应生成碳酸钠和氧气,该反应化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,过氧化钠和二氧化碳的反应中有一半的过氧化钠作氧化剂,另一半作还原剂,1mol过氧化钠反应转移电子1mol,则lmolH发生该反应转移电子数为6.02×1023 或 NA,
,该化合物和B与D形成的某化合物二氧化碳反应生成碳酸钠和氧气,该反应化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,过氧化钠和二氧化碳的反应中有一半的过氧化钠作氧化剂,另一半作还原剂,1mol过氧化钠反应转移电子1mol,则lmolH发生该反应转移电子数为6.02×1023 或 NA,故答案为:
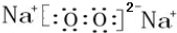 ;2Na2O2+2CO2=2Na2CO3+O2;6.02×1023 或 NA;
;2Na2O2+2CO2=2Na2CO3+O2;6.02×1023 或 NA;(5)若X为正盐,为碳酸铵,碳酸铵中含有离子键和共价键,故答案为:离子键和共价键;
(6)N和Cl两种元素相比较,原子得电子能力较强的为氯,
a.这两种元素的单质都是分子晶体,单质的熔沸点与分子间作用力有关,与得电子难易程度无关,所以不能比较得电子能力强弱,故错误;
b.二者形成的化合物中,F元素的原子显负价,说明F元素得电子能力大于B,故正确;
c.比较这两种元素的气态氢化物的稳定性,元素的非金属性越强,其氢化物的稳定性越强,所以可以其得电子能力强弱,故正确;
故答案为:氯;bc;
(7)金属元素Fe可与Cl形成化合物FeCl3,将Fe与石墨用导线相连浸入FeCl3溶液中形成一个原电池,该原电池工作时,Fe作负极、石墨作正极,负极上Fe失电子发生氧化反应,正极上铁离子得电子发生还原反应,则石墨一极发生的反应可以表示为2Fe3++2e-═2Fe2+,根据离子方程式2Fe3++Fe═3Fe2+知,当Fe溶解56gFe时转移2mol电子,则当有l.2mole-转移时单质G质量变化=
| 1.2mol |
| 2mol |
故答案为:2Fe3++2e-═2Fe2+;33.6;
(8)氢氧燃料碱性电池中,通入氢气的电极是负极、通入氧气的电极是正极,则甲为负极、乙为正极,负极反应式为H2-2e-+2OH-=2 H2O,
故答案为:H2-2e-+2OH-=2 H2O.
看了现有A、B、C、D、E、F、G...的网友还看了以下:
某学生先仰视读出32mL的水,然后倒出部分水,最后俯视读数为20mL,他实际倒出水的数值是()A. 2020-05-14 …
一个生活中的计算题,四个人合租,不同时间搬出去,没有记水表数,水费怎么分最合理?A、B、C、D合租 2020-05-22 …
数学题设排水管AB高出地面1.5米,在B处有一个自动旋转的喷水头喷头B与水流最高点C的连线与地面成 2020-06-04 …
知道平均日污水量,如何求最高日污水量最高日污水量(m3/d)=最高日用水量*污水排放收集系数平均日 2020-06-15 …
当外界溶液营养质量分数小于植物细胞溶液质量分数时,植物根毛细胞将A失水.B吸水.C先吸水后失水.D 2020-06-15 …
下列说法正确的是()A.使用金属来制作炊具,是利用了其化学性质B.自然界的水都或多或少含有杂质,所 2020-07-10 …
1.下列说法正确的是()A.在水的三态中分布最广的是液态水,其次是固态水,然后是大汽水B.固态水仅 2020-07-18 …
山水之“最”请你根据前面的意思,把后面的成语填写完整数量最多的山水——()山()水数量最少的山水— 2020-07-24 …
用同一滴管分别滴下相同体积的氢氧化钠水溶液、纯水、乙醇水溶液,它们滴数的关系为A水的滴数最少,氢氧化 2020-11-29 …
世界上大多数河流,最重要的补给形式和最稳定的补给水源分别是()A.雨水和地下水B.雨水和湖水C.大气 2021-02-05 …