早教吧作业答案频道 -->化学-->
重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程
题目详情
重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
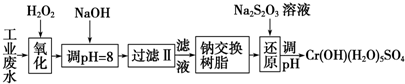
注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
(1)氧化过程中可代替H2O2加入的试剂是___(填序号,下同)
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是___;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是___
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为___.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?___(填“能”或“不能”),理由是___.
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为___时才能使c(Cr3+)降至
10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是___;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是___
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为___.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?___(填“能”或“不能”),理由是___.
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为___时才能使c(Cr3+)降至
10-5 mol•L-1.
▼优质解答
答案和解析
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为8Cr3+,再调节pH得到Cr(OH)(H2O)5SO4,
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,同时不能引入新的杂质,所以可以用Na2O2代替H2O2,故答案为:A;
(2)根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+被除去;通过钠离子交换树脂,除去Ca2+和Mg2+;
故答案为:AB;CD;
(3)每消耗0.8mol Cr2O72-转移4.8mol e-,则1molCr2O72-转移6mol电子,所以生成Cr3+,S2O32-被氧化为SO42-+,则反应的离子方程式为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
II.(1)若用Cu电极来代替Fe电极,在阳极上铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应,
故答案为:不能;因阳极产生的Cu2+不能使Cr2O72-还原到低价态;
(2)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=
=10-9 mol/L,
c(H+)═
=10-5mol/L,pH=5,
即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,
故答案为:5.
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,同时不能引入新的杂质,所以可以用Na2O2代替H2O2,故答案为:A;
(2)根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+被除去;通过钠离子交换树脂,除去Ca2+和Mg2+;
故答案为:AB;CD;
(3)每消耗0.8mol Cr2O72-转移4.8mol e-,则1molCr2O72-转移6mol电子,所以生成Cr3+,S2O32-被氧化为SO42-+,则反应的离子方程式为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
II.(1)若用Cu电极来代替Fe电极,在阳极上铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应,
故答案为:不能;因阳极产生的Cu2+不能使Cr2O72-还原到低价态;
(2)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=
| 3 |
| ||
c(H+)═
| 10 -14 |
| 10 -9 |
即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,
故答案为:5.
看了重金属元素铬的毒性较大,含铬废...的网友还看了以下:
关于结晶水,判断结晶水的个数.题文:六价铬对人体有毒,含铬废水要经过化学处理后才能排放.工业上为处 2020-05-13 …
“转变传统观念,推行低碳生活”的主题旨在倡导节约能源和利用清洁能源,减少温室气体二氧化碳的排放.下 2020-05-16 …
某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案 2020-06-11 …
某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案 2020-06-11 …
物理中的能如何理解?能量是什么意思? 2020-06-14 …
废品收购站今天收购了7吨废纸,用这些废纸大约可以生产白纸5吨,生产1吨白纸大约要砍20棵树.1.每 2020-06-19 …
形容忘我工作的词如废寝忘食 2020-06-19 …
生活垃圾一般可以分为三类:,如废纸和废塑料;,如果皮、菜叶和剩饭菜等;,如废电池、废灯管等,通常采 2020-06-22 …
回答如下几个问题(1)近期发现不需要外加能源、节约水源而能除去废水中的卤代烷(有碍于人类健康)的方 2020-06-28 …
一张练习簿纸重2克,人们如果每人每天回收一张废纸,我国13亿人每年就能回收废纸多少吨?一吨废纸可再 2020-07-01 …