早教吧作业答案频道 -->化学-->
氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物.(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4molN-H键断裂,则形
题目详情
氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物.
(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N-H键断裂,则形成的π键有___mol,N2H4的沸点比C2H6的主要原因是___.
(2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型为___.
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图.写出该反应的化学方程式:___.
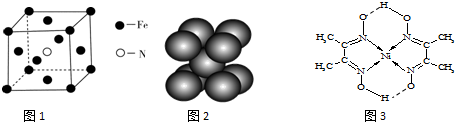
(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是
___(填序号).
a.常温下,N2很稳定,是因为N的电离能大
b.钠晶胞结构见图2,每个晶胞含有5个钠原子
c.第一电离能(I1):N>O>P>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
(5)配合物Y的结构见图3,Y中含有___(填序号);
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
Y中碳原子的杂化方式有___.
(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N-H键断裂,则形成的π键有___mol,N2H4的沸点比C2H6的主要原因是___.
(2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型为___.
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图.写出该反应的化学方程式:___.

(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是
___(填序号).
a.常温下,N2很稳定,是因为N的电离能大
b.钠晶胞结构见图2,每个晶胞含有5个钠原子
c.第一电离能(I1):N>O>P>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
(5)配合物Y的结构见图3,Y中含有___(填序号);
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
Y中碳原子的杂化方式有___.
▼优质解答
答案和解析
(1)1mol氮气分子中含有2molπ键,若该反应中有4mol-H键断裂,即有1mol肼参加反应,生成1.5mol氮气,所以形成的π键有1.5mol×2=3mol,N2H4分子间可形成氢键,而乙烷分子间不能形成氢键,分子间含有氢键的沸点较高,所以N2H4沸点(113.5℃)比乙烷沸点(-88.6℃)高得多,
故答案为:3;N2H4间能形成分子间氢键;
(2)NF3中含有3个δ键,且孤电子对数为
=1,则应为sp3杂化,空间构型为三角锥形,
故答案为:三角锥形;
(3)该晶胞中铁原子个数=8×
,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3
2Fe4N+3H2,
故答案为:8Fe+2NH3
2Fe4N+3H2;
(4)a.氮气中存在N≡N,N≡N的键能很大,不容易断裂,所以N2很稳定,故a错误;
b.钠晶胞中Na占据8个顶点和中心,根据均摊法确定其晶胞中的原子数为:8×
+1=2,故b错误;
c.非金属性越强,第一电离能越大,同周期从左到右第一电离能增大,第IIA与第IIIA,第VA族与第VIA反常,所以第一电离能:N>O>P>S,故c正确;
d.离子半径越小,晶格能越大,半径:Na+<K+,则晶格能:NaN3>KN3,故d错误;
故答案为:c;
(5)根据图可知碳碳间形成非极性共价键、碳氮间为极性共价键,氮镍间为配位键,氧氢间形成氢键,根据图可知,碳碳间形成单键,为sp3杂化,有的碳碳间形成双键,为sp2杂化,
故答案为:abcd;sp3、sp2.
故答案为:3;N2H4间能形成分子间氢键;
(2)NF3中含有3个δ键,且孤电子对数为
| 5-3 |
| 2 |
故答案为:三角锥形;
(3)该晶胞中铁原子个数=8×
| 1 |
| 8 |
| ||
故答案为:8Fe+2NH3
| ||
(4)a.氮气中存在N≡N,N≡N的键能很大,不容易断裂,所以N2很稳定,故a错误;
b.钠晶胞中Na占据8个顶点和中心,根据均摊法确定其晶胞中的原子数为:8×
| 1 |
| 8 |
c.非金属性越强,第一电离能越大,同周期从左到右第一电离能增大,第IIA与第IIIA,第VA族与第VIA反常,所以第一电离能:N>O>P>S,故c正确;
d.离子半径越小,晶格能越大,半径:Na+<K+,则晶格能:NaN3>KN3,故d错误;
故答案为:c;
(5)根据图可知碳碳间形成非极性共价键、碳氮间为极性共价键,氮镍间为配位键,氧氢间形成氢键,根据图可知,碳碳间形成单键,为sp3杂化,有的碳碳间形成双键,为sp2杂化,
故答案为:abcd;sp3、sp2.
看了 氮元素可形成氢化物、卤化物、...的网友还看了以下:
等差数列an中如果存在正整数k和L(k不等于L),使得前k项和Sk=k/L,前l项和SL=L/k, 2020-04-27 …
化学物质的量物质组成氧化亚铁三氧化二铁四氧化三铁三种氧化物中,与等量铁原子上结合的氧原子的质量比为 2020-05-13 …
等差数列an中如果存在正整数k和L(k不等于L),使得前k项和Sk=k/L,前l项和SL=L/k, 2020-05-19 …
设直线l的方程为(a+1)x-y+2-a=o(a∈R)(1)若L在两坐标轴上截距相等,求L的方程( 2020-06-07 …
数学中的符号L1,L∞,原文中说一向量x∈L1∩L∞∩C0L1中1为下标;L∞中∞为下标;C0中0 2020-07-09 …
随着化学工业的发展,当前发展以CH4、CO2等为原料的“C1化学”成为当今化工生产的必然趋势.所谓“ 2020-11-04 …
抗体的结构如图1所示,它有两条H链和两条L链组成.同一物种C区氨基酸序列恒定,不同抗体结合抗原的V区 2020-12-24 …
X、Y、Z3种元素位于同周期的相邻3个主族,原子序数依次增大.X的最高正化合价数与负化合价相等;Y原 2021-01-05 …
化学实验中常常出现“1+1=2”的有趣现象。下列符合“l+l=2”的事实是()A.常温下,1L水与1 2021-01-12 …
化学实验中常常出现“1+1=2”的有趣现象.下列符合“l+l=2”的事实是()A.常温下,1L水与1 2021-01-12 …