早教吧作业答案频道 -->化学-->
Cu、Zn、Cr都是过渡元素,可作为中心原子形成多种配合物.(1)下列不能作为配合物配位体的是(选填序号).A.H2OB.NH3C.CH4D.Cl-(2)用氢键表示式写出氨水中NH3分子
题目详情
Cu、Zn、Cr都是过渡元素,可作为中心原子形成多种配合物.
(1)下列不能作为配合物配位体的是___(选填序号).
A.H2O B.NH3 C.CH4 D.Cl-
(2)用氢键表示式写出氨水中NH3分子与水分子间形成的可能存在的氢键___.
(3)Cu元素可形成[Cu(NH3)4]SO4,其中存在的化学键类型有___(填序号).
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(4)若[Cu(H2O)4]2+具有对称的空间构型,且当其中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(H2O4]2+的空间构型为___(填字母).
a.平面正方形 b.正四面体 c.三角锥型 d.V形
(5)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后沉淀溶解形成深蓝色的溶液.写出此蓝色沉淀溶解的离子方程式:___;
(6)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+.交换出来的H+和已知量的NaOH溶液反应,即可求出x和n,确定配离子的组成.
将含0.0015mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200mol•L-1NaOH溶液25.00ml,该配离子的化学式为___.
(1)下列不能作为配合物配位体的是___(选填序号).
A.H2O B.NH3 C.CH4 D.Cl-
(2)用氢键表示式写出氨水中NH3分子与水分子间形成的可能存在的氢键___.
(3)Cu元素可形成[Cu(NH3)4]SO4,其中存在的化学键类型有___(填序号).
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(4)若[Cu(H2O)4]2+具有对称的空间构型,且当其中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(H2O4]2+的空间构型为___(填字母).
a.平面正方形 b.正四面体 c.三角锥型 d.V形
(5)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后沉淀溶解形成深蓝色的溶液.写出此蓝色沉淀溶解的离子方程式:___;
(6)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+.交换出来的H+和已知量的NaOH溶液反应,即可求出x和n,确定配离子的组成.
将含0.0015mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200mol•L-1NaOH溶液25.00ml,该配离子的化学式为___.
▼优质解答
答案和解析
(1)A.H2O是共价化合物,是由原子和氢原子形成共价键,电子式为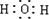 ,有孤对电子,可以作为配体,故A不选;
,有孤对电子,可以作为配体,故A不选;
B.NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为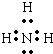 ,有孤对电子,可以作为配体,故B不选;
,有孤对电子,可以作为配体,故B不选;
C.碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为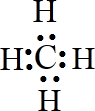 ,无孤对电子,不可以作为配体,故C选;
,无孤对电子,不可以作为配体,故C选;
D.Cl-为氯原子得到1个电子形成的阴离子,电子式为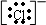 ,有孤对电子,可以作为配体,故D不选;
,有孤对电子,可以作为配体,故D不选;
故答案为:C;
(2)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、O-H…O、N-H…N,氨水中NH3分子与水分子间形成的可能存在的氢键N-H…O、O-H…N,
故答案为:N-H…O、O-H…N;
(3)[Cu(NH3)4]SO4中,[Cu(NH3)4]2+与SO42-之间的化学键为离子键,[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,[Cu(NH3)4]SO4,
故答案为:①③⑤;
(4)形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如果为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,
故答案为:a;
(5)氢氧化铜沉淀可以溶于过量的氨水中,发生反应:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O;
(6)中和生成的H+需浓度为0.1200mol/L氢氧化钠溶液25.00mL,由H++OH-=H2O,可以得出H+的物质的量为0.12mol/L×25.00×10-3L=0.003mol,
所以x=
=2,则[CrCln(H2O)6-n]2+中Cr的化合价为+3价,则有3-n=2,解得n=1,即该配离子的化学式为[CrCl(H2O)5]2+,
故答案为:[CrCl(H2O)5]2+.
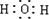 ,有孤对电子,可以作为配体,故A不选;
,有孤对电子,可以作为配体,故A不选;B.NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为
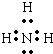 ,有孤对电子,可以作为配体,故B不选;
,有孤对电子,可以作为配体,故B不选;C.碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为
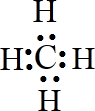 ,无孤对电子,不可以作为配体,故C选;
,无孤对电子,不可以作为配体,故C选;D.Cl-为氯原子得到1个电子形成的阴离子,电子式为
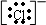 ,有孤对电子,可以作为配体,故D不选;
,有孤对电子,可以作为配体,故D不选;故答案为:C;
(2)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、O-H…O、N-H…N,氨水中NH3分子与水分子间形成的可能存在的氢键N-H…O、O-H…N,
故答案为:N-H…O、O-H…N;
(3)[Cu(NH3)4]SO4中,[Cu(NH3)4]2+与SO42-之间的化学键为离子键,[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,[Cu(NH3)4]SO4,
故答案为:①③⑤;
(4)形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如果为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,
故答案为:a;
(5)氢氧化铜沉淀可以溶于过量的氨水中,发生反应:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O;
(6)中和生成的H+需浓度为0.1200mol/L氢氧化钠溶液25.00mL,由H++OH-=H2O,可以得出H+的物质的量为0.12mol/L×25.00×10-3L=0.003mol,
所以x=
| 0.003mol |
| 0.0015mol |
故答案为:[CrCl(H2O)5]2+.
看了 Cu、Zn、Cr都是过渡元素...的网友还看了以下:
`挺容易滴``某同学用实验测定水的组成,用氢气充分还原20克氧化铜,生成16克铜和4.5克水.问: 2020-04-25 …
某溶液中含有Ba,Cu,Ag,现用NaOH溶液.盐酸和NaSO(4)溶液将这三种离子逐一沉淀分离. 2020-05-02 …
海水中的镁元素的一些问题,1.镁元素的存在形式(不止一种)以及如何相互转化2.镁元素在深海沉积物中 2020-05-16 …
3因素选取最优水平该怎样设计实验?实验为3因素,3者之间会存在交互作用该怎样去设计实验3个因素只是 2020-05-16 …
已知室温下,Cu(OH)2的Ksp或溶解度远大于Fe(OH)3.向浓度均为0.1mol•L-1的F 2020-07-03 …
化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用.(1)高温超导材 2020-07-15 …
根据下列反应事实写出相应的化学方程式.(1)双氧水在二氧化锰的催化作用下生成水和氧气:.(2)在尘 2020-07-23 …
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制 2020-11-02 …
知道正交分析表,是3因素4水平的.但是怎么具体列实验表啊?水平1,水平2,水平3,水平4因素1ABC 2020-11-27 …
每年三.四月是河豚的繁殖季节,此时体内的毒素含量较高,问:引起河豚毒素含量增大的非生物因素是什么?1 2020-12-08 …