早教吧作业答案频道 -->化学-->
铁元素不仅可以与SCN-、CN-等离子形成配合物,还可以与CO、NO等分子以及许多有机试剂形成配合物,回答下列问题:(1)基态铁原子有个未成对电子,Fe2+的电子排布式为,常用SCN-检验Fe
题目详情
铁元素不仅可以与SCN-、CN-等离子形成配合物,还可以与CO、NO等分子以及许多有机试剂形成配合物,回答下列问题:
(1)基态铁原子有___个未成对电子,Fe2+的电子排布式为___,常用SCN-检验Fe2+,二者可按n:1(n=1~6)的个数比形成血红色配合物,该配合物的化学式用通式表示为___.
(2)CN-有毒,含CN-的工业废水必须处理,用TiO2作光催化剂可将废水中的CN-转化为OCN-,并最终氧化为N2、CO2.
①C、N、O三种元素的第一电离能由大到小的顺序是___.
②与CN-互为等电子体的一种分子为___(填化学式);1molFe(CN)43-中含有σ键的数目为___.
③铁与CO形成的配合物Fe(CO)5的熔点为-20.5℃,沸点103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于___(填晶体类型).
(3)乙二胺四乙酸能和Fe3+形成稳定的水溶性配合物乙二胺四乙酸铁钠,原理如图1:
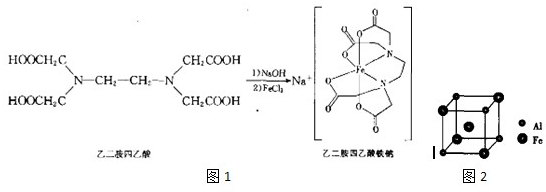
①乙二胺四乙酸中碳原子的杂化轨道类型是___.
②乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因是___.
(4)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成,小立方体如图2所示,则该合金的化学式___,已知小立方体的边长为0.289nm,此铁铝合金的密度为___g•cm-3.
(1)基态铁原子有___个未成对电子,Fe2+的电子排布式为___,常用SCN-检验Fe2+,二者可按n:1(n=1~6)的个数比形成血红色配合物,该配合物的化学式用通式表示为___.
(2)CN-有毒,含CN-的工业废水必须处理,用TiO2作光催化剂可将废水中的CN-转化为OCN-,并最终氧化为N2、CO2.
①C、N、O三种元素的第一电离能由大到小的顺序是___.
②与CN-互为等电子体的一种分子为___(填化学式);1molFe(CN)43-中含有σ键的数目为___.
③铁与CO形成的配合物Fe(CO)5的熔点为-20.5℃,沸点103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于___(填晶体类型).
(3)乙二胺四乙酸能和Fe3+形成稳定的水溶性配合物乙二胺四乙酸铁钠,原理如图1:

①乙二胺四乙酸中碳原子的杂化轨道类型是___.
②乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因是___.
(4)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成,小立方体如图2所示,则该合金的化学式___,已知小立方体的边长为0.289nm,此铁铝合金的密度为___g•cm-3.
▼优质解答
答案和解析
(1)基态铁原子的核外电子排布为:1s2 2s2 2p6 3s2 3p6 3d6 4s2,3d6中,最多容纳10个电子,现在有6个,先占据单个的,所以只有2个成对,还有4个未成对;
铁原子失去两个电子变为二价铁离子,其电子排布为:1s2 2s2 2p6 3s2 3p6 3d6 ;依据化合价代数和为0可知:硫氰合铁通式为:[Fe(SCN)n](3-n)+;
故答案为:4;1s2 2s2 2p6 3s2 3p6 3d6 ;[Fe(SCN)n](3-n)+;
(2)①同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C.由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序是N>O>C;
故答案为:N>O>C;
②与CN-互为等电子体的一种分子中有2个原子且价电子数为10,可以是CO;
1molFe(CN)43-中CN含有C、N三键,其中1个是σ键,N原子有孤对电子,铁原子有空轨道,所以每个铁离子与CN-形成4个配位键,所以共用8个σ键,1molFe(CN)43-中含有σ键数为8mol,个数为8NA;
故答案为:CO;8NA;
③Fe(CO)5的熔沸点低,且易溶于四氯化碳,依据分子晶体熔沸点低,且存在相似相溶原理,可知Fe(CO)5为分子晶体;
故答案为:分子晶体;
(3)①乙二胺四乙酸中碳原子为-CH2-,-COOH,前者碳原子以单键连接4个原子为四面体结构,为sp3杂化,-COOH中碳原子含有1个双键,为sp2杂化;
故答案为:sp2、sp3;
②乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,所以乙二胺(H2NCH3CH2NH3)和三甲胺[N(CH3)2]均属于胺,但乙二胺比三甲胺的沸点高得多;
故答案为:乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)依据铁铝合金晶胞结构铝原子的数目为4×
=
;铁原子数目为1+4×
=
,所以铝原子与铁原子个数之比为1:3,该铁铝合金的化学式为:AlFe3;
一个小立方体质量为
+
=161.96×10-23g;
所以其密度ρ=
═
=6.71g/cm3,
故答案为:AlFe3;6.71.
铁原子失去两个电子变为二价铁离子,其电子排布为:1s2 2s2 2p6 3s2 3p6 3d6 ;依据化合价代数和为0可知:硫氰合铁通式为:[Fe(SCN)n](3-n)+;
故答案为:4;1s2 2s2 2p6 3s2 3p6 3d6 ;[Fe(SCN)n](3-n)+;
(2)①同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C.由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序是N>O>C;
故答案为:N>O>C;
②与CN-互为等电子体的一种分子中有2个原子且价电子数为10,可以是CO;
1molFe(CN)43-中CN含有C、N三键,其中1个是σ键,N原子有孤对电子,铁原子有空轨道,所以每个铁离子与CN-形成4个配位键,所以共用8个σ键,1molFe(CN)43-中含有σ键数为8mol,个数为8NA;
故答案为:CO;8NA;
③Fe(CO)5的熔沸点低,且易溶于四氯化碳,依据分子晶体熔沸点低,且存在相似相溶原理,可知Fe(CO)5为分子晶体;
故答案为:分子晶体;
(3)①乙二胺四乙酸中碳原子为-CH2-,-COOH,前者碳原子以单键连接4个原子为四面体结构,为sp3杂化,-COOH中碳原子含有1个双键,为sp2杂化;
故答案为:sp2、sp3;
②乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,所以乙二胺(H2NCH3CH2NH3)和三甲胺[N(CH3)2]均属于胺,但乙二胺比三甲胺的沸点高得多;
故答案为:乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)依据铁铝合金晶胞结构铝原子的数目为4×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 3 |
| 2 |
一个小立方体质量为
| 27 |
| 2×6.02×1023 |
| 56×3 |
| 2×6.02×1023 |
所以其密度ρ=
| m |
| V |
| 161.96×10-23g |
| 0.0289×0.0289×0.0289cm3 |
故答案为:AlFe3;6.71.
看了 铁元素不仅可以与SCN-、C...的网友还看了以下:
孟德尔基因分离定律的实质是()A.减数分裂形成配子时,等位基因随同源染色体的分离而分离B.减数分裂 2020-04-11 …
下面有关孟德尔遗传规律的叙述,正确的是()A.基因分离定律的实质是控制相同性状的遗传因子发生分离B 2020-04-11 …
基因分离定律的实质是A.F1减数分裂形成配子时同源染色体彼此分离B.F1自交产生的F2出现性状分离 2020-04-11 …
关于配合物[Cu(H2O)4]SO4,下列说法错误的是()A.此配合物,中心离子的配位数为4B.H 2020-05-13 …
对于机械做功,下列说法中正确的是()A.省距离的机械可以省功,但一定费力B.省力的机械可以省功,但 2020-06-16 …
研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强,则配位体与中心离子形成 2020-06-18 …
有一种三体玉米,染色体数为2n+1=21,其体细胞中5号染色体有三条,三体在减数分裂时,三条同源染 2020-07-01 …
在杂种高茎豌豆自交后代中,同时出现高茎豌豆和矮茎豌豆的现象叫做()A.性状分离B.基因分离C.自由 2020-07-05 …
下列说法正确的是()A.省力的机械一定费距离,不省功B.省距离的机械一定省力,但不省功C.省力的机械 2020-11-03 …
下列说法正确的是()A.省力的机械一定费距离,不省功B.省距离的机械一定省力,但不省功C.省力的机械 2020-11-03 …