早教吧作业答案频道 -->化学-->
氯及其化合物在生活和生产中应用广泛.(1)已知:900Κ时,4HCl(g)+O2⇌2Cl2(g)+2H2O(g),反应自发.①该反应是放热还是吸热,判断并说明理由.②900K时,体积比为4:1的HCl和O2在
题目详情
氯及其化合物在生活和生产中应用广泛.
(1)已知:900 Κ时,4HCl(g)+O2⇌2Cl2(g)+2H2O(g),反应自发.
①该反应是放热还是吸热,判断并说明理由___.
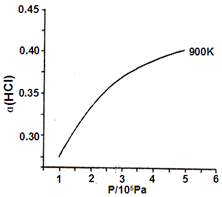
②900K时,体积比为4:1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(P)变化曲线如图.保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(P)变化曲线示意图.
(2)巳知:
Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△Hl=-102kJ•mol-1
3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△H2=-422kJ•mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:___.
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol•L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为c1 mol•L-1,写出该时刻溶液中Cl-浓度的表达式:
c(Cl-)=___mol•L-1(用c0、c1表示)
③有研究表明,生成NaClO3的反应分两步进行:
I 2ClO-=ClO2-+Cl-
II ClO2-+ClO-=ClO3-+Cl-
常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:___.
(3)电解NaClO3水溶液可制备NaClO4.在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降.为抑制氢气的产生,可选择合适的物质(不引入杂质),写出该电解的总化学方程式___.

(1)已知:900 Κ时,4HCl(g)+O2⇌2Cl2(g)+2H2O(g),反应自发.
①该反应是放热还是吸热,判断并说明理由___.
②900K时,体积比为4:1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(P)变化曲线如图.保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(P)变化曲线示意图.
(2)巳知:
Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△Hl=-102kJ•mol-1
3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△H2=-422kJ•mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:___.
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol•L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为c1 mol•L-1,写出该时刻溶液中Cl-浓度的表达式:
c(Cl-)=___mol•L-1(用c0、c1表示)
③有研究表明,生成NaClO3的反应分两步进行:
I 2ClO-=ClO2-+Cl-
II ClO2-+ClO-=ClO3-+Cl-
常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:___.
(3)电解NaClO3水溶液可制备NaClO4.在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降.为抑制氢气的产生,可选择合适的物质(不引入杂质),写出该电解的总化学方程式___.
▼优质解答
答案和解析
(1)①900 Κ时,4HCl(g)+O2⇌2Cl2(g)+2H2O(g),△S<0,反应自发满足△H-T△S<0,△H<0,故答案为:放热,△S<0,反应自发满足△H-T△S<0;
②900K时,体积比为4:1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(P)变化曲线如图.保持其他条件不变,升温到T K,平衡逆向进行,HCl转化率减小,随压强增大平衡正向进行,HCl转化率增大,据此画出图象为: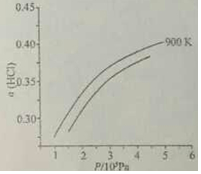 ,
,
故答案为: ;
;
(2)①Ⅰ.Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△Hl=-102kJ•mol-1
Ⅱ.3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△H2=-422kJ•mol-1
盖斯定律计算Ⅱ-Ⅰ×3得到NaClO分解生成NaClO3的热化学方程式:
3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol,
故答案为:3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol;
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol•L-1,则Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)反应中生成氯离子浓度为c0 mol•L-1,加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为c1 mol•L-1,反应的次氯酸钠浓度=c0 mol•L-1-c1 mol•L-1
3NaClO(aq)=2NaCl(aq)+NaClO3(aq)
3 2 1
c0 mol•L-1-c1 mol•L-1
×(c0 mol•L-1-c1 mol•L-1)
该时刻溶液中Cl-浓度的表达式:c0 mol•L-1+
×(c0 mol•L-1-c1 mol•L-1 )=
,
故答案为:
;
③③常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,说明反应进行决定于反应Ⅰ,反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化,
故答案为:反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化;
(3)电解NaClO3水溶液可制备NaClO4.在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降.为抑制氢气的产生,可选择合适的物质氧气和氢气反应生成水,该电解池中电解的化学方程式为:2NaClO3+O2
2NaClO4,
故答案为:2NaClO3+O2
2NaClO4;
②900K时,体积比为4:1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(P)变化曲线如图.保持其他条件不变,升温到T K,平衡逆向进行,HCl转化率减小,随压强增大平衡正向进行,HCl转化率增大,据此画出图象为:
 ,
,故答案为:
 ;
;(2)①Ⅰ.Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△Hl=-102kJ•mol-1
Ⅱ.3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△H2=-422kJ•mol-1
盖斯定律计算Ⅱ-Ⅰ×3得到NaClO分解生成NaClO3的热化学方程式:
3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol,
故答案为:3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol;
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol•L-1,则Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)反应中生成氯离子浓度为c0 mol•L-1,加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为c1 mol•L-1,反应的次氯酸钠浓度=c0 mol•L-1-c1 mol•L-1
3NaClO(aq)=2NaCl(aq)+NaClO3(aq)
3 2 1
c0 mol•L-1-c1 mol•L-1
| 2 |
| 3 |
该时刻溶液中Cl-浓度的表达式:c0 mol•L-1+
| 2 |
| 3 |
| 5c0-2c1 |
| 3 |
故答案为:
| 5c0-2c1 |
| 3 |
③③常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,说明反应进行决定于反应Ⅰ,反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化,
故答案为:反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化;
(3)电解NaClO3水溶液可制备NaClO4.在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降.为抑制氢气的产生,可选择合适的物质氧气和氢气反应生成水,该电解池中电解的化学方程式为:2NaClO3+O2
| ||
故答案为:2NaClO3+O2
| ||
看了氯及其化合物在生活和生产中应用...的网友还看了以下:
广告英语的语言特点是什么?使用的是什么句式?请把你搜集到的其他广告用语写在下面七年级暑假生活指导第 2020-06-12 …
硅(Si)是信息技术的关键材料,常用以下方法制得纯硅,如图所示:(1)图中①、③发生了置换反应,请 2020-07-06 …
下列广告语运用的修辞手法判别正确的是()1.使头发根根柔顺,令肌肤寸寸滑嫩(香皂广告)2.千里之行 2020-07-16 …
一个数学问题广告板一块800元/月,现在要用30块,使用12个月。合计是288000元。然后人家说将 2020-12-05 …
英语翻译1.论图形创意在广告设计中的作用2.图形创意在广告设计中具有灵魂的作用.3.〔关键词〕图形创 2020-12-06 …
17.如今是一个传媒发达的时代,广告在商品营销中所占的地位、所起到的作用越来越重要,请写下一句你喜欢 2020-12-06 …
某电视台连续播放6个广告,其中有3个不同的商业广告,2个不同的奥运宣传广告,1个公益广告.要求最后播 2020-12-12 …
某电视台连续播放5个广告,其中有3个不同的商业广告和2个不同的公益广告,要求最后播放的不能是商业广告 2020-12-30 …
(2006•上海)电视台连续播放6个广告,其中含4个不同的商业广告和2个不同的公益广告,要求首尾必须 2020-12-30 …
电视台连续播放6个广告,其中含4个不同的商业广告和2个不同的公益广告,要求首尾必须播放公益广告,则共 2020-12-30 …