早教吧作业答案频道 -->化学-->
在白色点滴板上进行Na2SO3的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:(1)a中实验现象是,该现象可证明Na2SO3具有性.(2)b中发生反应
题目详情
在白色点滴板上进行Na2SO3的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:
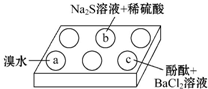
(1)a中实验现象是___,该现象可证明Na2SO3具有___性.
(2)b中发生反应的离子方程式是___.
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)___.
(4)在用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
①当吸收液中n(SO32-):n(HSO3-)=10:1时,溶液中离子浓度关系正确的是___(选填编号).
a.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
c.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO2___L.

(1)a中实验现象是___,该现象可证明Na2SO3具有___性.
(2)b中发生反应的离子方程式是___.
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)___.
(4)在用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
a.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
c.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO2___L.
▼优质解答
答案和解析
(1)滴入溴水后褪色,说明溴被还原,亚硫酸钠具有还原性,被溴单质氧化为硫酸钠,故答案为:溴水褪色;还原;
(2)b中是滴入硫化钠溶液和稀硫酸,硫离子和亚硫酸根离子发生氧化还原反应生成淡黄色沉淀单质硫,发生反应的离子方程式是:SO32-+2S2-+6H+=3S↓+3 H2O;
故答案为:SO32-+2S2-+6H+=3S↓+3 H2O;
(3)d中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去,在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O⇌HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),水解平衡左移,氢氧根离子浓度减小,红色褪去;
故答案为:在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O⇌HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去;
(4)①吸收液中n(SO32-):n(HSO3-)=10:1 时,依据图表数据分析判断,溶液呈碱性,亚硫酸钠物质的量大于亚硫酸氢钠
a、依据溶液中电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-);故a正确;
b、溶液中亚硫酸钠多溶液呈碱性,亚硫酸根离子大于亚硫酸氢根离子,钠离子浓度最大,离子浓度大小为:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
;故b错误;
c、溶液中亚硫酸钠多溶液呈碱性,亚硫酸根离子大于亚硫酸氢根离子,钠离子浓度最大,离子浓度大小为:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
;故c正确;
故答案为:ac;
②若n(SO32-):n(HSO3-)=3:2,反应物全部反应,直平得到反应方程式为:5SO2+8NaOH=2NaHSO3+3Na2SO3+3H2O,则0.8mol NaOH溶液吸收了标准状况下的SO2物质的量为0.5mol,标准状况体积为0.5mol×22.4L/mol=11.2L;
故答案为:11.2.
(2)b中是滴入硫化钠溶液和稀硫酸,硫离子和亚硫酸根离子发生氧化还原反应生成淡黄色沉淀单质硫,发生反应的离子方程式是:SO32-+2S2-+6H+=3S↓+3 H2O;
故答案为:SO32-+2S2-+6H+=3S↓+3 H2O;
(3)d中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去,在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O⇌HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),水解平衡左移,氢氧根离子浓度减小,红色褪去;
故答案为:在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O⇌HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去;
(4)①吸收液中n(SO32-):n(HSO3-)=10:1 时,依据图表数据分析判断,溶液呈碱性,亚硫酸钠物质的量大于亚硫酸氢钠
a、依据溶液中电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-);故a正确;
b、溶液中亚硫酸钠多溶液呈碱性,亚硫酸根离子大于亚硫酸氢根离子,钠离子浓度最大,离子浓度大小为:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
;故b错误;
c、溶液中亚硫酸钠多溶液呈碱性,亚硫酸根离子大于亚硫酸氢根离子,钠离子浓度最大,离子浓度大小为:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
;故c正确;
故答案为:ac;
②若n(SO32-):n(HSO3-)=3:2,反应物全部反应,直平得到反应方程式为:5SO2+8NaOH=2NaHSO3+3Na2SO3+3H2O,则0.8mol NaOH溶液吸收了标准状况下的SO2物质的量为0.5mol,标准状况体积为0.5mol×22.4L/mol=11.2L;
故答案为:11.2.
看了在白色点滴板上进行Na2SO3...的网友还看了以下:
下列滴定,能否用直接法滴定?若可,计算化学计量点的PH,并选择指示剂.(1)0.10mol/LHc 2020-07-14 …
应用题.1一种液体每升含有上千亿个有害细菌,为了试验某种杀菌剂的药效,科研人员进行试验,发现一滴杀菌 2020-11-03 …
(2011•宝山区一模)化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按如下图所 2020-11-15 …
滴定混合碱时,以酚酞为指示剂,滴定至终点,消耗HCl标准溶液V1mL,再以滴定混合碱时,以酚酞为指示 2020-11-23 …
用滴定管测浓度时,如果指示剂滴加过多,计算结果为什么变大?在用中和滴定实验中,用标准盐酸滴定氢氧化钠 2020-11-23 …
用滴管吸取和滴加少量试剂,下列操作中不正确的是A将滴管伸入试剂瓶中,然后用手指头捏紧橡胶乳头,赶走滴 2020-11-25 …
用滴管吸取和滴加少量试剂,下列操作中不正确的是A.将滴管伸入试剂瓶中,然后用手指头捏紧橡胶乳头,赶走 2020-11-25 …
1.一种液体每升含有上千亿个有害细菌,为了试验某种杀菌剂的药效,科学家们进行了实验,发现一滴杀菌剂可 2020-12-21 …
医院确认糖尿病的常用方法是将上列哪种试剂滴于尿样中?[]A.加入苏丹III溶液,出现橘黄色B.加入碘 2020-12-24 …
数理报数学题——初二在线等!1种被污染的液体每升含有2.4*10的13次方个有害细菌科学家发现1滴可 2021-02-04 …