早教吧作业答案频道 -->化学-->
甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)═CH3OH(g)△H1=-99kJ.mol-1,②CO2(g)+3H2(g)═CH3OH(g)+H2
题目详情
甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H1=-99kJ.mol-1,
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-58kJ.mol-1
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
(1)写出CO2的结构式___
(2)由上述数据计算出△H3=___kJ.mol-1
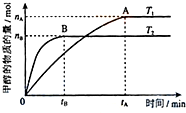
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,温度T1、T2对反应的影响,下列正确的是___(填序号)
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=
mol/(L•min)
②该反应在T1时的平衡常数比T2时的小
③当生成1mol甲醇的同时,生成1molCO2,说明反应达到平衡n
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入体积为2L的密闭恒容器中,充分反应达到平衡后,若CO2转化率为50%,则容器内的压强与起始压强之比为___;该温度条件下,反应平衡常数为___(计算出结果)
(5)在直接以甲醇为燃料电池中,电解质溶液为硫酸性,负极的电极反应式为___.
①CO(g)+2H2(g)═CH3OH(g)△H1=-99kJ.mol-1,
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-58kJ.mol-1
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:

(1)写出CO2的结构式___
(2)由上述数据计算出△H3=___kJ.mol-1
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,温度T1、T2对反应的影响,下列正确的是___(填序号)
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=
| nA |
| tA |
②该反应在T1时的平衡常数比T2时的小
③当生成1mol甲醇的同时,生成1molCO2,说明反应达到平衡n
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入体积为2L的密闭恒容器中,充分反应达到平衡后,若CO2转化率为50%,则容器内的压强与起始压强之比为___;该温度条件下,反应平衡常数为___(计算出结果)
(5)在直接以甲醇为燃料电池中,电解质溶液为硫酸性,负极的电极反应式为___.
▼优质解答
答案和解析
(1)二氧化碳中C原子和O原子间为双键,故二氧化碳的结构式为O=C=O,故答案为:O=C=O;(2)已知反应:①CO(g)+2H2(g)═CH3OH(g)△H1=-99kJ.mol-1,②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-58kJ.mol...
看了甲醇是重要的化工原料.利用合成...的网友还看了以下:
张老师有10000元存银行2年,有2种方法:一存2年,年利率2.97%;一种是先存一年,年利率2. 2020-06-03 …
(1)月利率0.21%,折合年利率为.(2)年利率2.4%,折合月利率为(1)月利率0.21%,折 2020-06-13 …
活期年利率0.35%三个月年利率2.35%半年年利率2.55%如果本金是3000,求活期,三活期年 2020-07-16 …
复利公式如何推出?c=利息p=本金s=本息额n=期限r=利率单利c=p*r*ns=c+p复利s=p 2020-07-23 …
把100元存入银行一年,到期后可共得本息102.4元(已扣除20%的利息税),那么这种存款的月利率 2020-07-23 …
小强把500元存入银行,整存整取二年,年利率是2.70%,求到期他得到的税后利息(税率是利息的20 2020-07-26 …
小明2005年1月存款4000元,年利率是2.31%,到2006年1月他可得的税后利息计算方法是( 2020-07-26 …
利用(a+b+c)^2=a^2+b^2^c^2+2ab+2ac+abc,推导(a+b+c)^2+a 2020-07-30 …
50000存银行,年利率2.50%,存30年!每年所得的利息不取回!没计算器复利的(12.50%)的 2020-11-28 …
金融问题谢谢了1.我国银行同业拆借利率属于()。(A)官定利率(B)公定利率(C)市场利率(D)优惠 2020-12-16 …