早教吧作业答案频道 -->化学-->
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)⇔C8H8(g)+H2(g)△H=125kJ•mol-1I.某温度下,将0.40mol苯乙烷,充人2L真空密闭容器中发生反应,测定不同时间该容器
题目详情
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
C8H10(g)⇔C8H8(g)+H2(g)△H=125kJ•mol-1
I.某温度下,将0.40mol苯乙烷,充人2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
(1)当反应进行到20min时,该段时间内H2的平均反应速率是___.
(2)该温度下,该反应的化学平衡常数是___.
(3)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是___.此时,该反应是否达到了平衡状态?___(填“是”或“否”)
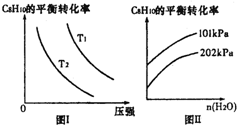
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图I、图Ⅱ所示.
(4)由图I可知,T1___T2 (填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,平衡转化率将___(填“越大”、“越小”或“不变”),原因是___.
C8H10(g)⇔C8H8(g)+H2(g)△H=125kJ•mol-1
I.某温度下,将0.40mol苯乙烷,充人2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)该温度下,该反应的化学平衡常数是___.
(3)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是___.此时,该反应是否达到了平衡状态?___(填“是”或“否”)
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图I、图Ⅱ所示.
(4)由图I可知,T1___T2 (填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,平衡转化率将___(填“越大”、“越小”或“不变”),原因是___.

▼优质解答
答案和解析
I.(1)将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,20min后,剩余0.26mol,减少了0.14mol,
C8H10(g)⇌C8H8(g)+H2(g)
起始(mol) 0.40 0 0
变化(mol) 0.14 0.14 0.14
20min(mol) 0.26 0.14 0.14
v(H2)=
=0.0035mol/(L•min)
故答案为:0.0035mol/(L•min);
(2)C8H10(g)⇌C8H8(g)+H2(g)
起始(mol/L) 0.20 0 0
变化(mol/L) 0.08 0.08 0.08
30min(mol/L) 0.12 0.08 0.08
化学平衡常数K=
=
=0.053;
故答案为:0.053;
(3)根据C8H10(g)⇌C8H8(g)+H2(g)△H=125kJ•mol-1,可知 C8H8(g)+H2(g)⇌C8H10(g)△H=-125kJ•mol-1,有30kJ热量放出时,消耗的H2量为0.24mol,所以氢气转化率=
×100%=
×100%=60%;
根据(2)知:平衡常数=0.053,则C8H8(g)+H2(g)⇌C8H10(g)的平衡常数为
=18.75,
C8H8(g)+H2(g)⇌C8H10(g)
起始(mol/L) 0.2 0.2 0
变化(mol/L) 0.12 0.12 0.12
某时刻(mol/L) 0.08 0.08 0.12
=
=18.75=18.75,反应达到平衡状态;
故答案为:60%;是;
Ⅱ.(4)C8H10(g)⇌C8H8(g)+H2(g)△H=125kJ•mol-1,温度升高,平衡正向移动,C8H10的转化率增大,由图I可知,压强相同时,T1时C8H10的转化率大于T2时C8H10的转化率,故T1大于T2;
故答案为:大于;
(5)其他条件不变,水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大;
故答案为:越大;水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大.
C8H10(g)⇌C8H8(g)+H2(g)
起始(mol) 0.40 0 0
变化(mol) 0.14 0.14 0.14
20min(mol) 0.26 0.14 0.14
v(H2)=
| ||
| 20min |
故答案为:0.0035mol/(L•min);
(2)C8H10(g)⇌C8H8(g)+H2(g)
起始(mol/L) 0.20 0 0
变化(mol/L) 0.08 0.08 0.08
30min(mol/L) 0.12 0.08 0.08
化学平衡常数K=
| c(C8H8)•c(H2) |
| c(C8H10) |
| 0.08×0.08 |
| 0.12 |
故答案为:0.053;
(3)根据C8H10(g)⇌C8H8(g)+H2(g)△H=125kJ•mol-1,可知 C8H8(g)+H2(g)⇌C8H10(g)△H=-125kJ•mol-1,有30kJ热量放出时,消耗的H2量为0.24mol,所以氢气转化率=
| 消耗量 |
| 起始量 |
| 0.24mol |
| 0.4mol |
根据(2)知:平衡常数=0.053,则C8H8(g)+H2(g)⇌C8H10(g)的平衡常数为
| 1 |
| 0.053 |
C8H8(g)+H2(g)⇌C8H10(g)
起始(mol/L) 0.2 0.2 0
变化(mol/L) 0.12 0.12 0.12
某时刻(mol/L) 0.08 0.08 0.12
| c(C8H10) |
| c(C8H8)c(H2) |
| 0.12 |
| 0.08×0.08 |
故答案为:60%;是;
Ⅱ.(4)C8H10(g)⇌C8H8(g)+H2(g)△H=125kJ•mol-1,温度升高,平衡正向移动,C8H10的转化率增大,由图I可知,压强相同时,T1时C8H10的转化率大于T2时C8H10的转化率,故T1大于T2;
故答案为:大于;
(5)其他条件不变,水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大;
故答案为:越大;水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大.
看了苯乙烷(C8H10)可生产塑料...的网友还看了以下:
(1/4)k.s:英语作文:说明:假定你是wendy,请根据以下内容写一份邮件,写信人:Wendy 2020-05-13 …
甲乙两人玩纸牌游戏从足够数量的纸牌中取牌规定每人最多两种取法,甲每次取4张或(4-k)张,乙每次取 2020-06-06 …
已知a,b是方程x^2-2(k-1)x+k+1=0的两实根……已知a,b是方程x^2-2(k-1) 2020-06-07 …
甲、乙两人玩纸牌游戏,从足够数量的纸牌中取牌.规定每人最多两种取法,甲每次取4张或(4-k)张,乙 2020-06-20 …
已知集合A={x|x=k+1/4,k∈Z},B={x|x=k/2-1/4,k∈Z},C={x|x= 2020-06-26 …
已知集合A={x|x=k/2+1/4,k∈Z},B={x|x=k/4+1/2,k∈Z},试确定集合 2020-06-26 …
求直线L是否过X轴上的一定点,若过定点,给出证明,并求出该定点;若不过,请说明理由.直线L[(2- 2020-07-31 …
4+k^2)x^2-2k(2+k)x+(k+2)^2-8=0x=k(2+k)/(k^2+4)(k^ 2020-08-02 …
角焊缝焊脚K,K<12+3K>12+4是什么意思?这个是T形手工焊.水利水电工程2.4-2焊缝外观质 2020-11-27 …
(2012•重庆)甲、乙两人玩纸牌游戏,从足够数量的纸牌中取牌.规定每人最多两种取法,甲每次取4张或 2020-12-02 …