早教吧作业答案频道 -->化学-->
碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:(1)实验室中制取少量碘可采用如下方法:KI+CuSO4→A(白色)↓+K2SO4+I2.16.0gCuSO4与过量KI反应后可得19.1g
题目详情
碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:
(1)实验室中制取少量碘可采用如下方法:KI+CuSO4→A (白色)↓+K2SO4+I2.16.0g CuSO4与过量KI反应后可得19.1g 的A,写出A的化学式:___.
工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3溶液反应后生成碘,写出此反应的离子方程式:___.
(2)单质碘与氟气反应可制得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2OH3O++OH-),生成的阳离子为IF4+,则阴离子为___.
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg•L-1之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的KI,再用NaOH溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液.(已知:2S2O32-+I2═S4O62-+2I-)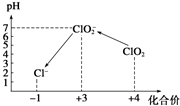
Ⅲ.加硫酸调节水样pH至1~3.
操作时,不同pH环境中粒子种类如图所示:
请回答:
①操作Ⅰ中反应的离子方程式是___.
②确定操作Ⅱ完全反应的现象是___.
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是___.
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3 mol•L-1的Na2S2O3溶液10mL,则水样中ClO2的浓度是___mg•L-1.
(1)实验室中制取少量碘可采用如下方法:KI+CuSO4→A (白色)↓+K2SO4+I2.16.0g CuSO4与过量KI反应后可得19.1g 的A,写出A的化学式:___.
工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3溶液反应后生成碘,写出此反应的离子方程式:___.
(2)单质碘与氟气反应可制得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2OH3O++OH-),生成的阳离子为IF4+,则阴离子为___.
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg•L-1之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的KI,再用NaOH溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液.(已知:2S2O32-+I2═S4O62-+2I-)

Ⅲ.加硫酸调节水样pH至1~3.
操作时,不同pH环境中粒子种类如图所示:
请回答:
①操作Ⅰ中反应的离子方程式是___.
②确定操作Ⅱ完全反应的现象是___.
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是___.
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3 mol•L-1的Na2S2O3溶液10mL,则水样中ClO2的浓度是___mg•L-1.
▼优质解答
答案和解析
(1)根据元素守恒知,A中含有Cu元素,该反应中I元素化合价由-1价变为0价,Cu元素得电子化合价降低,白色沉淀是Cu和I元素形成的化合物,n(CuSO4)=
=0.1mol,m(Cu)=64g/mol×0.1mol=6.4g,A中n(I)=
=0.1mol,n(Cu):n(I)=0.1mol:0.1mol=1:1,则A化学式为CuI;
碘酸根离子和亚硫酸根离子发生氧化还原反应生成硫酸根离子、碘、氢离子和水,离子方程式为2IO3-+5HSO3-=3H++5SO42-+I2+H2O,
故答案为:CuI;2IO3-+5HSO3-=3H++5SO42-+I2+H2O;
(2)根据水的电离方程式知,IF5电离方程式为2IF5⇌IF4++IF6-,所以生成的阳离子为IF4+,阴离子为IF6-,
故答案为:IF6-;
(3))①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2+2I-=2ClO2-+I2,
故答案为:2ClO2+2I-=2ClO2-+I2;
②加入一定量 Na2S2O3 溶液,发生反应为:2S2O32-+I2═S4O62-+2I-,使I2还原为I-,故蓝色会消失,故答案为:蓝色消失,半分钟内不变色;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,离子方程式为:ClO2-+4I-+4H+=Cl-+2I2+2H2O,
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④S2O32-~~~~I-~~~~ClO2
1 1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水样为 1L,所以 ClO2 的浓度为
=0.675 mg•L-1,
故答案为:0.675.
| 16.0g |
| 160g/mol |
| 19.1g-6.4g |
| 127g/mol |
碘酸根离子和亚硫酸根离子发生氧化还原反应生成硫酸根离子、碘、氢离子和水,离子方程式为2IO3-+5HSO3-=3H++5SO42-+I2+H2O,
故答案为:CuI;2IO3-+5HSO3-=3H++5SO42-+I2+H2O;
(2)根据水的电离方程式知,IF5电离方程式为2IF5⇌IF4++IF6-,所以生成的阳离子为IF4+,阴离子为IF6-,
故答案为:IF6-;
(3))①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2+2I-=2ClO2-+I2,
故答案为:2ClO2+2I-=2ClO2-+I2;
②加入一定量 Na2S2O3 溶液,发生反应为:2S2O32-+I2═S4O62-+2I-,使I2还原为I-,故蓝色会消失,故答案为:蓝色消失,半分钟内不变色;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,离子方程式为:ClO2-+4I-+4H+=Cl-+2I2+2H2O,
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④S2O32-~~~~I-~~~~ClO2
1 1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水样为 1L,所以 ClO2 的浓度为
| 0.675mg |
| 1L |
故答案为:0.675.
看了碘是生命体中的必需元素,请根据...的网友还看了以下:
与英国资产阶级革命相比,美国独立战争的最大特点是()A.革命前资本主义经济发展受到阻碍B.革命的任 2020-05-14 …
俄国作家契诃夫说:“活过来的人生要是一个草稿,能够把它再誊写一次该多好!”这句名言告诉我们()A. 2020-05-16 …
已知任意三角型abc,过a点做垂线到bc命点e,过b点做垂线到ac命为f,过c点做垂线到ab命点d 2020-05-20 …
主机SCSI写操作有以下主要步骤:(1)主机系统API接口将用户写操作转换为SCSI写操作,(2)发 2020-05-31 …
在国庆阅兵式中,某直升飞机在地面上某空高度A位置待命,接到上级命令,要该机10h56min40s由 2020-06-07 …
20世纪,一个独特的生命个体以其勇敢的方式震撼了世界,她就是海伦•凯勒--一个生活在黑暗中却又给人 2020-07-02 …
1在平面直角坐标系XY中,已知角A的定点为原点,其始边与X轴正半轴重合,终边过(3.M),且SIN 2020-07-30 …
比较早期三次资产阶级革命的异同,以下说法正确的是:A.原因方面:英法美三国都是有相同之处的,都是反对 2020-11-06 …
新民主主义革命时期,中国共产党的土地政策发生过几次变化,其主要依据是A.社会主要矛盾的变化B.社会性 2020-11-27 …
高中数学2道利用复合命题真假求参数取值范围的题,1、设命题:P:C的平方>C和命题q:对任何X∈R, 2020-12-13 …